A ligação covalente também
designada de ligação molecular se
estabelece geralmente entre átomos de elementos não metálicos (ametais). A ligação covalente ocorre
por meio do compartilhamento de
electrões entre os átomos.
Os átomos de elementos não metálicos têm tendência de receber electrões, assim, quando dois átomos de elementos não metálicos estabelecem uma ligação química o fazem por meio do compartilhamento de electrões isto porque nenhum dos átomos irá receber ou ceder electrões como acontece na ligação iónica. Quando é estabelecida a ligação covalente, o par de electrões compartilhado pelos átomos passa a pertencer simultaneamente aos dois átomos envolvidos na ligação. A força da ligação resulta da atracção que os núcleos dos átomos envolvidos nessa ligação exercem sobre os electrões compartilhados.
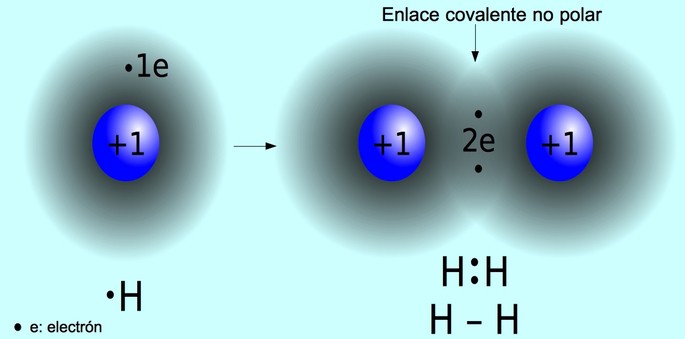
Para explicarmos como se estabelece a ligação covalente consideremos a
molécula de hidrogénio, H2.
O hidrogénio tem um (1) electrão na camada de valência, 1H, 1s1,
pelo que se estabiliza adquirindo a configuração electrónica idêntica a do
Hélio (He) que é o gás nobre mais próximo. Para conseguir adquirir esta
configuração estável, o hidrogénio pode-se ligar ao outro átomo de hidrogénio:
No entanto, visto que nenhum dos átomos pode ceder electrões ao outro, o
estabelecimento da ligação só é possível por meio do compartilhamento de
electrões entre os dois átomos:
Assim, o par de electrões compartilhado pertence simultaneamente aos dois
átomos, isto é, os dois electrões compartilhados pertencem simultaneamente ao
átomo de hidrogénio à esquerda e à direita de forma que cada átomo tem agora 2
electrões.
Por comodidade o par de electrões é geralmente representado por meio de um
traço:
Depois de analisarmos a molécula de hidrogénio, analisemos agora a molécula
de oxigénio, O2. Na formação desta molécula dois átomos de oxigénio
compartilham electrões entre si.
A configuração electrónica do oxigénio é: 8O : 1s2 2s2
2p4
Como se vê, o oxigénio tem na camada de valência apenas 6 electrões,
precisando de mais 2 electrões para alcançar a estabilidade química (ter 8
electrões na camada de valência segundo a regra de octeto).
Antes do compartilhamento de electrões, cada átomo de Oxigénio possuía somente 6
electrões mas com o compartilhamento de um par de electrões cada átomo tem
agora 7 electrões já que o par de electrões compartilhado pertence aos dois
átomos.
Entretanto, mesmo tendo efectuado o compartilhamento de um par de electrões
o oxigénio ainda não alcançou o octeto, isto é, não possui ainda os 8
electrões, para que isso aconteça é necessário realizar mais um
compartilhamento de electrões:
Agora, com os dois pares de electrões compartilhados, cada átomo de
oxigénio tem 8 electrões e portanto, o Oxigénio adquiriu a estabilidade química (tem uma
configuração electrónica semelhante a de um gás nobre). Portanto, temos:
Agora se considerarmos a molécula do nitrogénio, N2, praticamente
ocorrerá o mesmo que acabamos de explicar, isto é, o raciocínio é praticamente o
mesmo que já explicamos anteriormente. Neste caso, 3 pares de electrões são
compartilhados com vista ao alcance da estabilidade química de cada átomo de
nitrogénio.
Por: Miguel Pascoal
full-width















0 Comentários