1. Alguns factores podem alterar a rapidez das reacções
químicas. A seguir destacam-se três exemplos no contexto da preparação e da
conservação de alimentos:
1. A maioria dos produtos
alimentícios se conserva por muito mais tempo quando submetidos à refrigeração.
Esse procedimento diminui a rapidez das reacções que contribuem para a
degradação de certos alimentos.
2. Um procedimento muito
comum utilizado em práticas de culinária é o corte dos alimentos para acelerar
o seu cozimento, caso não se tenha uma panela de pressão.
3. Na preparação de
iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as
reacções envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os factores que influenciam
a rapidez das transformações químicas relacionadas na ordem 1, 2, 3:
A Temperatura, superfície de contacto e concentração
B Concentração, superfície de contacto e catalisadores
C Temperatura, superfície de contacto e catalisadores
D Superfície de contacto, temperatura e concentração
E Temperatura, concentração e catalisadores
RESOLUÇÃO
Os factores que influenciam a
velocidade de uma reacção química são a concentração
dos reagentes, a temperatura, a superfície de contacto, a natureza dos
reagentes e o catalisador.
Análise dos itens:
1. A refrigeração permite
uma redução (diminuição) da temperatura e consequentemente, possibilita a
diminuição da energia cinética média das partículas reagentes o que implica na
diminuição da velocidade da reacção.
2. O corte dos alimentos
permite reduzir o seu tamanho. O grau de divisão das partículas está
relacionado a superfície de contacto. A superfície de contacto é a área
disponível num reagente para ele puder entrar em contacto com o outro reagente.
Quanto maior for esta área maior será a superfície de contacto e
consequentemente maior é a velocidade da reacção.
Se tivermos quantidade
iguais (mesma massa) de alimentos cortados e outros não cortados, os que
estiverem cortados vão apresentar maior superfície de contacto que os alimentos
não cortados.
3. As enzimas são
catalisadores biológicos. Catalisam reacções bioquímicas (reacções químicas que
ocorrem nos organismos vivos). Os catalisadores são
substâncias que aumentam a velocidade da reacção sem sofrerem alteração
permanente, isto é, não são consumidas durante a reacção. Popularmente diz-se
que o catalisador “diminui a energia de activação fazendo a reacção ocorrer com
maior velocidade”. Na prática, os catalisadores criam um caminho alternativo
para a reacção que requer uma energia de activação menor, fazendo com que a
reacção ocorra com maior rapidez.
Portanto, no texto fala-se dos seguintes factores:
1 – temperatura; 2 – superfície de contacto; 3 – catalisadores.
Resposta: alternativa: C
2. A equação X + Y →
XY2 representa uma reacção cuja expressão da lei de velocidade é V =
k[X][Y]. Qual será o valor da constante de velocidade, sabendo que a
concentração de X é 1 M e a de Y 2 M, a uma velocidade de 3 M min-1?
A 3,0 M-1 min-1
B 1,5 M min-1
C 1,0 M-1 min-1
D 3,0 M min-1
E 1,5 M-1 min-1
RESOLUÇÃO
Tendo a expressão da Lei
de Velocidade, V = k[X][Y], podemos isolar a constante de velocidade k, e de
seguida podemos efectuar a substituição dos dados para acharmos o valor da
constante de velocidade:
Dados:
V = 3 M min-1
[X] = 1 M e [Y] = 2 M
A expressão da lei de
velocidade é: V = k[X][Y].
Vamos isolar a constante de velocidade (K):
Veja que a após cálculo, o “M” no numerador
desaparece mas fica um “M” no denominador. Assim, o inverso de “M” é escrito
como “M-1”.
Por isso a alternativa B está errada! A
alternativa correcta é exactamente E.
Resposta: alternativa: E
3. Considere a reacção: M(g) + N(g) →
O(g)
Observa-se
experimentalmente que, duplicando-se a concentração de N, a velocidade de
formação de O quadruplica; e, duplicando-se a concentração de M, a velocidade
da reacção não é afectada. A equação da
velocidade V dessa reacção é:
A V =k[M]2
B V =k[N]2
C V =k[M]
D V =k[M][N]
E V =k[M][N]2
RESOLUÇÃO
Sabe-se que a velocidade da reacção é directamente proporcional a concentração dos reagentes. Se a velocidade de formação de O (velocidade da reacção) quadruplica quando duplica-se a concentração de N isso significa que a velocidade da reacção é directamente proporcional ao quadrado da concentração de N, ou seja, [N] está elevada ao expoente 2, [N]2.
Se a velocidade
da reacção não é afectada quando se duplica a concentração de M quer dizer que
a velocidade da reacção não depende do reagente M, portanto, M não tem
influência na velocidade da reacção, logo a ordem da reacção em relação ao
reagente M é zero, [M]0. Assim, M não aparece na expressão da lei de
velocidade.
Portanto, a
expressão da lei de velocidade é:
V = k[M]0[N]2
⇔ V = k[N]2
Vamos demonstrar isso:
A expressão geral
da lei de velocidade pode ser escrita como:
V = k[M]a[N]b
Ordem do reagente
M
Temos que manter o N constante:
V1 = k[M]a
A velocidade da
reacção não se altera quando a concentração de M duplica:
V1 = k(2[M])a ⇒ V1 = k ·2a · [M]a
Portanto, V = k[M]a ⇒ V = k[M]0 ⇒ V = k
Obs: Todo número
com expoente zero é igual a 1: a0 = 1.
Ordem do reagente
N
Temos que manter o M constante:
V1 = k[N]b
A velocidade da
reacção quadruplica (aumenta 4 vezes) quando a concentração de N duplica:
4V1 = k(2[N])b ⇒ 4V1 = k ·2b · [N]b
Portanto, V =
k[N]b ⇒ V = k[N]2
Assim, a
expressão da lei de velocidade é:
V = k[N]2
Resposta: alternativa: B
4. A reacção de decomposição de amoníaco gasoso foi
realizada num recipiente fechado é 2NH3
→ N2 + 3H2
A tabela abaixo indica a
variação na concentração de reagente em função do tempo.
|
Concentração de
NH3 em mol L-1 |
8,0 |
6,0 |
4,0 |
1,0 |
|
Tempo em horas |
0 |
1 |
2 |
3 |
Qual é a velocidade média
de consumo do reagente nas duas primeiras horas de reacção?
A 4,0 mol L-1h-1
B 2,0 mol L-1h-1
C 10,0 mol L-1h-1
D 1,0 mol L-1h-1
E 2,3 mol L-1h-1
RESOLUÇÃO
A velocidade média de uma reacção é definida como sendo a alteração (variação) da concentração de um dos reagentes ou produtos, em um intervalo de tempo.
Dado que é comum na Matemática usarmos o delta (∆) para
indicar a variação, assim podemos escrever:
Onde:
• ∆ [ ] = Concentração final –
Concentração inicial (∆ [ ] = [ ]final
– [ ]inicial )
• ∆t = tempo final – tempo inicial (∆t = tfinal – tinicial )
Para o caso de um reagente a velocidade média é dada por:
Neste caso
fala-se da velocidade média de consumo
do reagente, portanto, da velocidade
média em função do reagente que no caso é o NH3.
Como a velocidade média é calculada em
função de um participante da reacção não
se inclui o coeficiente estequiométrico no cálculo da velocidade média.
Ao incluir o coeficiente estequiométrico no cálculo da
velocidade média o que se obtém é a velocidade
média da reacção como um todo
(velocidade com que a reacção como um todo se processa independentemente do
participante da reacção usado no cálculo) e neste caso não é o que se pede.
Portanto: 2NH3 → N2 + 3H2
Note que as primeiras duas horas correspondem ao intervalo 0h a 2h.
Cálculo da variação da concentração
∆[NH3] = [NH3]final – [NH3]inicial
∆[NH3] = 4,0 – 8,0
∆[NH3] = – 4,0 mol L-1
Cálculo da variação do tempo
∆t = tfinal – tinicial
∆t = 2 h – 0 h
∆t = 2 h
Velocidade de consumo de NH3
Resposta: alternativa: B
5. Um equilíbrio envolvido na formação da chuva ácida está
representado pela equação 2SO2(g)
+ O2(g) ↔ 2SO3(g).
Em recipiente de um
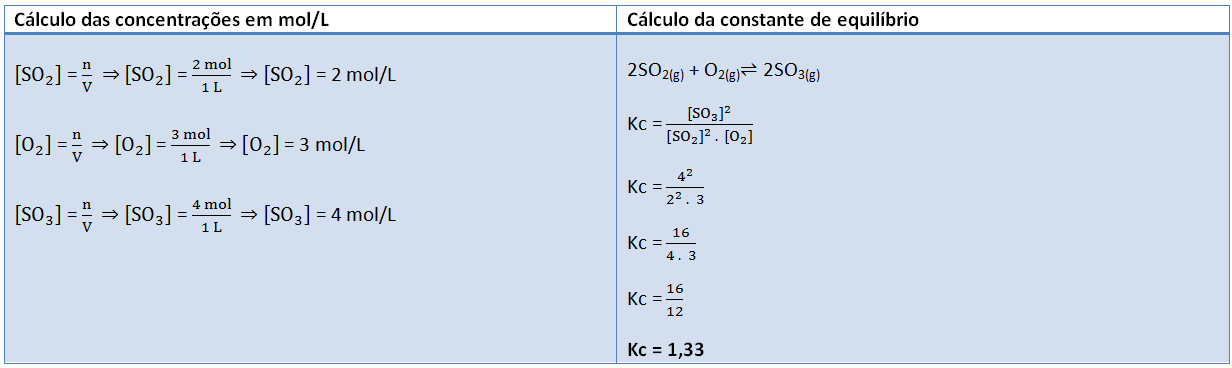
litro, foram misturados 6 moles de dióxido de enxofre e 5 moles de oxigénio.
Depois de algum tempo, o sistema atingiu o equilíbrio, e o número de moles de
trióxido de enxofre medido foi 4. O
valor aproximado da constante de equilíbrio é:
A 0,53
B 0,66
C 0,75
D 1,33
E 2,33
RESOLUÇÃO
Como explicámos no texto
Cálculo da Constante de Equilíbrio usando uma Tabela, exercícios desta natureza
são facilmente resolvidos usando-se uma tabela onde teremos três situações, o
início, a variação (concentração, número de moles, etc) e equilíbrio.
Neste caso as quantidades
das substâncias envolvidas estão expressas em mol. Depois dos cálculos na
tabela iremos calcular as concentrações em mol/L e depois a constante de
equilíbrio.
Equação da reacção: 2SO2(g)
+ O2(g) ⇌ 2SO3(g)
Tabela:
|
Fases da reacção |
SO2 |
O2 |
SO3 |
|
Início |
6 mol |
5 mol |
0 |
|
∆n |
|
|
|
|
Equilíbrio |
|
|
4 mol |
• Os 6 mol de SO2
e os 5 mol de O2 são as quantidades iniciais destas substâncias. A
quantidade de SO3 (produto) é nula no início pois a reacção ainda
não ocorreu. Por isso estes dados ficam na primeira linha.
• No fim (no equilíbrio)
a quantidade SO3 é de 4 mol. Mas como no início não havia nada de SO3
e no fim há 4 mol significa que durante a reacção formaram-se 4 mol de SO3,
por isso o valor foi repetido (na segunda linha: a vermelho);
|
Fases da reacção |
SO2 |
O2 |
SO3 |
|
Início |
6 mol |
5 mol |
0 |
|
∆n |
|
|
4 mol |
|
Equilíbrio |
|
|
4 mol |
• As quantidades de SO2 e O2 consumidas podem ser determinadas através da equação da reacção por meio de um simples cálculo estequiométrico obecedendo a proporção estequiométrica mostrada pela equação da reacção devidamente acertada:
• Os valores encontrados
serão colocados na segunda linha (∆n):
|
Fases da reacção |
SO2 |
O2 |
SO3 |
|
Início |
6 mol |
5 mol |
0 |
|
Reage/Forma |
4 mol |
2 mol |
4 mol |
|
Equilíbrio |
|
|
4 mol |
• Dado que durante a reacção os reagentes são consumidos e os produtos formados, para acharmos as quantidades de SO2 e O2 no equilíbrio, vamos pegar as quantidades iniciais e subtrair as quantidades que foram consumidas e teremos assim as quantidades no equilíbrio:
|
Fases da reacção |
SO2 |
O2 |
SO3 |
|
Início |
6 mol |
5 mol |
0 |
|
Reage/Forma |
4 mol |
2 mol |
4 mol |
|
Equilíbrio |
6 mol – 4 mol = 2 mol |
5 mol – 2 mol = 3 mol |
0 + 4 mol = 4 mol |
Assim fica:
|
Fases da reacção |
SO2 |
O2 |
SO3 |
|
Início |
6 mol |
5 mol |
0 |
|
Reage/Forma |
4 mol |
2 mol |
4 mol |
|
Equilíbrio |
2 mol |
3 mol |
4 mol |
Como sabemos as quantidades no equilíbrio são elas que usamos no cálculo da constante de equilíbrio. Mas note que neste caso estão expressas em mol, então é necessário calcular primeiro das concentrações em mol/L antes de calcular a constante de equilíbrio.
Resposta: alternativa: D
6. Dadas as seguintes
afirmações:
I. Durante o equilíbrio
químico a velocidade da reacção directa é igual a da reacção inversa
II. Antes de se atingir o
equilíbrio químico a concentração dos reagentes diminui e a dos produtos
aumenta
III. Atingido o
equilíbrio, a concentração das substâncias intervenientes na reacção permanece
constante
IV. Um exemplo de uma
reacção de equilíbrio é a que ocorre entre H2(g) e I2)g)
na formação de HI(g)
A (s) afirmação correcta (s) é (são):
A Somente I e III
B Somente III e IV
C Somente I e II
D Somente I, II e IV
E Todas
RESOLUÇÃO
Numa reacção reversível, inicialmente a concentração dos reagentes é máxima
e à medida que a reacção vai ocorrendo a concentração dos reagentes vai
diminuindo (a velocidade da reacção directa diminui). Na sequência os produtos
vão sendo formados, assim, a concentração dos produtos aumenta (a velocidade da
reacção inversa cresce). Depois de algum tempo atinge-se o equilíbrio químico
onde a velocidade da reacção directa iguala-se a velocidade da reacção inversa.
Em suma as
características do estado de equilíbrio são as seguintes:
• No estado de equilíbrio a velocidade da reacão
directa (Vd) é igual a velocidade da reacção inversa (Vi);
• A concentração dos reagentes e produtos não se altera, ou seja, as
concentrações tornam-se constantes;
• O Equilíbrio químico é Dinâmico;
• O equilíbrio químico só pode ser alcançado num sistema fechado mantido a tamperatura constante.
Alguns
exemplos de reacções em equilíbrio são:
N2(g)
+ 3H2(g) ⇌ 2NH3(g)
H2(g)
+ I2(g) ⇌ 2HI(g)
Resposta: alternativa: E
7. A concentração [H+]
de uma solução 6 x 10-7 mol/L do ácido H2S, com uma constante
de ionização do primeiro estágio de dissociação Ki1 de 10-7, é igual
a:
A 5,1 x 10-7 mol/L
B 6,0 x 10-7 mol/L
C 3,0 x 10-6
mol/L
D 2,4 x 10-7
mol/L
E 4,3 x 10-7
mol/L
RESOLUÇÃO
Vamos escrever a equação de ionização deste ácido. É importante destacar
que por ser um ácido diprótico, a ionização ocorre em etapas, no entanto, a
constante de ionização da primeira etapa é suficientemente maior que a da etapa
seguinte:
H2S(aq) ⇌ H+(aq) + HS-(aq)
Tabela de concentrações
|
|
[H2S] |
[H+] |
[HS-] |
|
Início |
6 · 10-7 |
0 |
0 |
|
∆[ ] |
- x |
+x |
+x |
|
Equilíbrio |
6 · 10-7 – x |
x |
x |
Cálculo da concentração de H+
Portanto, a concentração de H+ é: [H+] = x = 2,4 · 10-7
mol/L
Resposta: alternativa: D
8. Considere uma solução saturada de cloreto de prata contendo resíduo no
fundo. Adicionando pequena quantidade de
cloreto de sódio sólido, qual é a modificação observada no resíduo contido?
A Aumentará
B diminuirá
C permanecerá constante
D diminuirá e depois aumentará
E aumentará e depois diminuirá
RESOLUÇÃO
O equilíbrio que se
estabelece é: AgCl(s) ⇌ Ag+(aq)
+ Cl-(aq)
O cloreto de prata sólido
está em equilíbrio com os iões Ag+ e Cl- presentes na
solução saturada deste sal. Quando se adiciona o cloreto de sódio (NaCl), por
ser um sal muito solúvel, este dissocia-se completamente segundo a equação:
NaCl(s) → Na+(aq)
+ Cl-(aq)
Portanto, quando o NaCl se dissolve liberta iões Cl-
que já existiam no meio, ou seja, o Cl- é comum na solução de AgCl e
de NaCl. Assim, quando o NaCl se dissocia libertando os iões Na+
e Cl-, ocorre o aumento da concentração de Cl-.
Devido ao aumento da concentração de iões Cl-,
segundo o Princípio de Le Chatelier, vai ocorrer o deslocamente de equilíbrio
para a esquerda, ou seja, sentido de formação de AgCl sólido. Portanto, a
quantidade de AgCl não dissolvido irá aumentar em resultado do deslocamento de
equilíbrio à esquerda por causa da presença do ião comum nesta solução.
Dica: Estude o efeito
do ião comum na solubilidade (Equilíbrio Iónico).
Resposta: alternativa: A
9. “Quando um factor externo age sobre um sistema em equilíbrio,
este se desloca, procurando minimizar a acção do factor aplicado” – H. L. Le
Chatelier, 1888.
De acordo com este princípio, numa reacção exotérmica, em
que os reagentes estão no estado sólido e os produtos no estado gasoso...
A aumentando-se a pressão, o equilíbrio é deslocado no
sentido dos produtos.
B aumentando-se a temperatura, o equilíbrio é deslocado no
sentido dos produtos.
C aumentando-se a
concentração dos reagentes, o equilíbrio é deslocado no sentido dos mesmos
D adicionando catalisador, o equilíbrio é deslocado no
sentido dos produtos
E aumentando-se a concentração dos produtos, o equilíbrio
desloca-se no sentidos dos reagentes.
RESOLUÇÃO
A transcrição “quando um factor externo age sobre um sistema em equilíbrio, este se
desloca, procurando minimizar a acção do factor aplicado” é o enunciado
do famoso Princípio de Le Chatelier.
Vamos analisar cada alternativa:
A INCORRECTA
Para que se possa avaliar o efeito da pressão no deslocamento de equilíbrio
no sistema deve haver substâncias no estado gasoso. Neste caso temos que somar
os coeficientes estequiométricos de todos os participantes que estejam no
estado gasoso na reacção nos reagentes e nos produtos. Assim teremos 3 casos
possíveis:
• Caso o somatório dos coeficientes estequiométricos dos reagentes no
estado gasoso seja maior que o
somatório dos coeficientes estequiométricos dos produtos no estado gasoso, o
aumento da pressão irá provocar o deslocamento de equilíbrio no sentido dos
produtos (formação dos produtos);
• Caso o somatório dos coeficientes estequiométricos dos reagentes no
estado gasoso seja igual ao somatório
dos coeficientes estequiométricos dos produtos no estado gasoso, a variação da
pressão não afecta o equilíbrio.
• Caso o somatório dos coeficientes
estequiométricos dos reagentes no estado gasoso seja menor que o somatório dos coeficientes estequiométricos dos
produtos no estado gasoso, o aumento da pressão irá provocar o deslocamento de
equilíbrio no sentido dos reagentes;
Neste caso é impossível determinar o
sentido em que se desloca o equilíbrio porque só temos os produtos no
estado gasoso e nenhum reagente no estado gasoso. Assim, não podemos somar os
coeficientes estequiométricos e fazer a comparação necessária.
B INCORRECTA
Como a reacção é exotérmica significa que a reacção directa é exotérmica e
a reacção inversa é endotérmica. Num sistema em equilíbrio, o aumento da temperatura
favorece a reacção endotérmica, portanto, aumentando a temperatura, a
equilíbrio deslocar-se-á para a esquerda, ou seja, sentido dos reagentes.
C INCORRECTA
O aumento da concentração dos reagentes provoca o deslocamento de
equilíbrio no sentidos dos produtos.
D INCORRECTA
O catalisador não provoca o deslocamento de equilíbrio pois só faz com que
o equilíbrio seja rapidamente alcançado já que altera igualmente as velocidades
das reacções directa e inversa.
E
CORRECTA
O aumento da concentração dos produtos provoca o deslocamento de equilíbrio
no sentidos dos reagentes.
Resposta: alternativa: E
10. Que alteração de pH, sofrem 10 L de água se lhe forem
adicionados 10-2 mol de NaOH?
A Aumenta em duas unidades
B Aumenta em três unidades
C Aumenta em quatro
unidades
D Reduz-se em quatro unidades
E Reduz-se em três unidades
RESOLUÇÃO
O hidróxido de sódio (NaOH) é uma base forte e em solução aquosa
dissocia-se completamente:
NaOH(aq) → Na+(aq)
+ OH-(aq)
A adição de NaOH à água faz com que o meio torne-se alcalino ou básico,
portanto, o pH eleva-se.
O pH da água pura é exactamente 7, assim a concentração de iões H+
é [H+] = 10-pH ⇒ [H+] = 10-7 M
Com adição de 10-2 mol de NaOH, temos que calcular o novo pH. Mas tratando-se de uma base que foi adicionada à água primeiro iremos calcular o pOH e depois o pH.
Cálculo da concentração
Cálculo de pOH
pOH = –log[OH-]
pOH = –log(10-3)
pOH = 3
Cálculo de pH
pH + pOH = 14
pH = 14 – 3
pH = 11
Portanto, com a adição de 10-2 mol de NaOH à água, o pH passa de
7 (pH = 7) para pH = 11:
∆pH = pH(solução) – pH(água pura)
∆pH = 11 – 7
∆pH = 4
Assim, o pH aumenta em 4 unidades.
Resposta: alternativa: C
GOSTOU DESTA RESOLUÇÃO E QUERIA TER ACESSO A VERSÃO COMPLETA? CLIQUE AQUI PARA COMPRAR A RESOLUÇÃO COMPLETA DESTE EXAME EM PDF OU CONTACTE 846767922.
PARA BAIXAR OS ENUNCIADOS DOS EXAMES DE ADMISSÃO DE QUÍMICA EM PDF clique aqui.
full-width
FIM







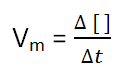











2 Comentários
Me salvou a vida com exercícios resolvidos
ResponderEliminar❤️
ResponderEliminar