
PRÉ-QUÍMICO
______________________________________________________________________
EXERCÍCIOS RESOLVIDOS SOBRE EQUILÍBRIO IÓNICO
___________________________________________________________________
1 . De acordo com a Teoria ácido-base de Bronsted, o ácido conjugado de água é…
A a hidróxila
B o hidrónio
C água oxigenada
D o hidrogénio
Resolução
A diferença estrutural entre os pares conjugados é de apenas um protão. E esses pares podem transformarem-se um no outro por cedência ou aceitação de protões.
No caso de H2O / H3O+ , note o seguinte, se a água (H2O) aceitar um protão transforma-se no ião hidrónio (H3O+ ) e se o ião hidrónio cede um protão transforma-se em água (H2O), portanto, o ácido conjugado da água é o hidrónio.
Resposta: alternativa: B
2 . No equilíbrio HNO3 + H2SO4 ↔ H2NO+3 + HSO -4 . O HN O3 e o anião HSO - 4 são…
A dois ácidos
B ácido e base
C duas bases
D base e ácido
Resolução
Note que no equilíbrio acima, o HNO3 aceita um protão cedido pelo H2SO4 e sabe-se que pela Teoria Ácido-Basede Bronsted-Lowry , a espécie química que aceita o protão é uma base e a espécie que cede o protão é um ácido , então podemos concluir que o HNO3 é uma base pois aceita um protão e o HSO -4 é também um a base pois também aceita o protão para voltar a ser H2SO 4 .
HNO3 + H2SO4 ↔ H2NO+3 + HSO -4
Base1 Ácido1 Ácido2 Base2
Resposta: alternativa: C
3 . Dada a seguinte reacção protolítica HA + H2O ↔ H3O + + A -
Os pares conjugados são…
A HA / H2O ; H3O+ / A -
B HA / A ; H2O / A-
C HA / A - ; H3O+ / H2O
D H3O+ / A - ; A- / H2O
Resolução
Como já foi dito a diferença estrutural entre os pares conjugados é de um protão . E esses pares podem transformarem-se um no outro por cedência ou aceitação de protões. Observe que o HA ao perder um protão transforma-se no A- e este A- ao receber o protão transforma-se no HA . Já no caso, H 2 O / H 3O+ , note o seguinte, se a água (H2O) aceitar um protão transforma-se no ião hidrónio (H3O+) e se o ião hidrónio cede um protão transforma-se em água (H2O). Logo: HA / A - e H 2O / H 3O + .
Resposta: alternativa: C
4 . Uma solução que apresenta concentração dos iões [H+ ] = 1•10-9 M é …
A ácida
B básica
C diluída
D neutra
Resolução
Para respondermos esta questão é melhor calcularmos o pH, embora de cabeça você possa responder:
Cálculo do pH
pH = -log[H+ ]
pH = -log( 1 ∙ 10-9 )
pH = -(-9)
pH = 9
Conclusão : pH > 7 , logo a solução é básica ou alcalina.
Resposta : alternativa: B
5 . Qual é o valor de Kb da base conjugada do ácido acético (CH3 - COOH), sabendo que o valor de Ka é igual a 1,8 ∙ 1 0-5 , a 25º C?
A 1,8 ∙ 10-10
B 5,5 ∙ 10-9
C 5,5 ∙ 10-10
D 1,8 ∙ 10-9
Resolução
Dados
Ka = 1,8 ∙ 10-5
Kw = 1,0 ∙ 10-14 (25o C)
Kb = ?
Sabe-se que existe uma relação entre Kw, Ka e Kb a qua l é expressão assim :
Kw = Ka ∙ Kb .
Kw = Ka ∙ Kb .
Substituindo os dados na fórmula acima podemos ter o seguinte. Observe:

Resposta: alternativa: C
6 . Uma solução de ácido fraco HCℓO foi analisada, tendo-se verificado no equilíbrio a existência das seguintes concentrações : [H3O+] = 1,78 ∙ 10-4 mol/l ; [ CℓO-] 1,78∙ 10-4 mol/l e [ HCℓO] =1,00 mol/l
A constante do ácido é….
A 31,68 ∙ 10-8
B 3,17 ∙ 10-9
C 3,17 ∙ 10-8
D 31,68∙ 10-10
Resolução
Primeiro vamos escrever a equação da ionização do ácido:
HCℓO(aq) ↔ H3O+(aq) + CℓO-(aq)

Resposta: alternativa: C
7 . Qual é a [OH-] numa solução em que a [H3O+] é igual à 1 ∙ 10-5 a 25o C?
A 1 ∙ 10-9
B 10 ∙ 10-11
C 10 ∙ 10-12
D 1 ∙ 10-12
Resolução
Dados
[H3O+] = 1 ∙ 10-5
Kw = 1,0 ∙ 10-14 (a 25o C).
[OH-] = ?
Nós sabemos que Kw é dado por Kw = [H3O+] ∙ [OH-] ou Kw = [H+] ∙ [OH-]

8 . O valor de Ka do CH3COOH a 25o C é igual a 1,7 ∙ 10-5M. O valor de Kb é...
A 1,7 ∙ 10-19 M
B 1,0 ∙ 10-14 M
C 5,9 ∙ 10-10 M
D 1,4 ∙ 10-2 M
Resolução
Ka = 1,7 ∙ 10-5
Kw = 1,0 ∙ 10-14 (25o C)
Kb = ?
Sabe-se que existe uma relação entre Kw, Ka e Kb a qua l é expressão assim :
Kw = Ka ∙ Kb .
Kw = Ka ∙ Kb .
Substituindo os dados na fórmula acima podemos ter o seguinte. Observe:
Kw = Ka ∙ Kb

Resposta: alternativa: C
9 . O grau de ionização do ácido acético numa solução aquosa 0.001M, cuja Ki = 1,8 ∙ 10-5 M é...
A 74 ∙ 10-4
B 7,4 ∙ 10-11
C 74 ∙ 10-13
D 1,34 ∙ 10-1
Resolução
Dados
[CH3-COOH] = 0.001M
Ki = 1,8 ∙ 10-5 M
α = ?
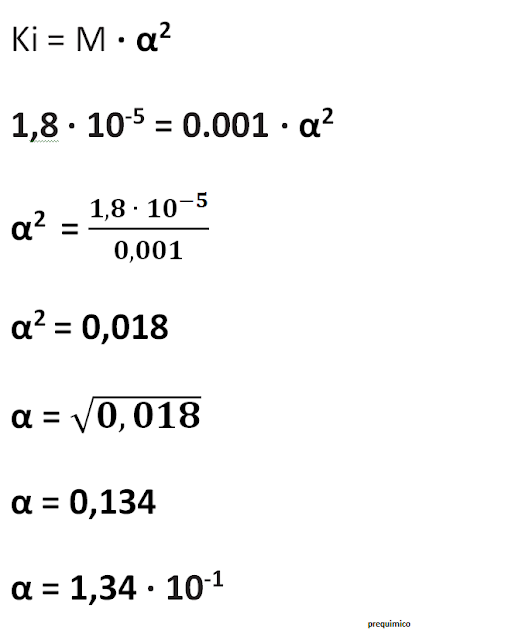
Resposta: alternativa: D
10 . Qual das seguintes substâncias em solução aquosa é um electrólito forte?
A KCN
B NaOH
C HCN
D NH3
De um modo geral, quanto maior for a tendência de se ionizar ou dissociar em solução aquosa, mais forte é o electrólito.
Resposta: alternativa: B
11 . O grau de ionização de uma solução de CH3-COOH a 0,045M com constante de ionização igual a 1,8 ∙ 10 -5 é ...
A 2%
B 4%
C 8%
D 20%
Resolução
Dados
[CH3-COOH] = 0.045M
Ki = 1,8 ∙ 10-5 M
α = ?
Ki = M ∙ α 2

Resposta: alternativa: A
12 . O pH da solução contendo [H+] igual a 1,8 ∙ 10-11 é?
A 10,74
B 11
C 12,74
D 14
Resolução
Dado
[H+] = 1,8 ∙ 10-11
pH = ?
Cálculo do pH
pH = log[H+]
pH = -log(1,8 ∙ 10-11 )
pH = 10,74
Resposta: alternativa: A
13 . A 60o C o produto iónico da água é Kw = 1,0 ∙ 10-13 M2 . Qual é o pH da solução neutral?
A 5,5
B 6,0
C 6,5
D 7,0
Resolução
Dados
Kw = 1,0 ∙ 10-13 ( 60o C)
[H+] = X
[OH-] = X
pH = ?
Nós sabemos que Kw é dado por Kw = [H3O+] ∙ [OH-] ou Kw = [H+] ∙ [OH-]
Como não sabemos quais são as concentrações de H+ e OH- é por isso que consideramos X. E agora substituindo na fórmula:
Kw = [H+] ∙ [OH-]
Como a [H+] é X e já sabemos que X é 3,16 ∙ 10-7 , logo [H+] = 3,16 ∙ 10-7 . E já podemos calcular o pH:
pH = log[H+]
pH = -log( 3,16 ∙ 10-7 )
pH –(log 3,16 + log 10-7 )
pH = - ( 0,49 – 7)
pH = - 0,49 + 7
pH = 6,5
Resposta: alternativa: C
14 . Mede-se o pH de soluções através de ...
A pH - metro e indicadores
B Indicadores e soluções ácidas
C Grau de ionização
D Ka e Kb
Resposta: alternativa: A
15 . Uma solução de NaOH a 0,00008M apresenta pH igual à...
A 9,9
B 8,1
C 5,9
D 4,1
Resolução
Dados
[NaOH] = 0,00008M = 8 ∙ 10-5
pH = ?
Como é uma base e quer se saber o seu pH, primeiro temos calcular o seu pOH e só depois o pH:
Cálculo do pOH
pOH = - log[OH-]
pOH = - log ( 8 ∙ 10-5 )
pOH = - (log 8 + log 10-5 )
pOH = - (0,90 – 5)
pOH = 4,1
Agora pela relação entre pH e pOH temos o seguinte:
pH + pOH = 14
pH + 4,1 = 14
pH = 14 – 4,1
pH = 9,9
Resposta: alternativa: A
16 . Qual das seguintes substâncias em solução aquosa é um electrólito forte?
A KCN
B CH3COOH
C NH3
D H2SO4
De um modo geral, quanto maior for a tendência de se ionizar ou dissociar em solução aquosa, mais forte é o electrólito.
Resposta: alternativa: D
17 . As concentrações de iões hidrónio e de iões hidróxila numa solução de pH = 10,3 são, respectivamente...
A 5,01 ∙ 10-11 M e 1,9 ∙ 10-4 M
B 1,9 ∙ 10-4 M e 5,01 ∙ 10-11 M
C 1,05 ∙ 10-10 M e 9,1 ∙ 10-5 M
D 10,3 M e 3, 7M
Resolução
Dado
pH = 10,3
Como o exercício pede-nos as concentrações dos iões hidrónio (H3O+ ) e hidroxila (OH-) , no entanto, para termos a concentração do OH - temos que calcular o pOH primeiro:
pH + pOH = 14
10,3 + pOH = 14
pOH = 14 – 10,3
pOH = 3,7
Feito isto, ficamos já com o s seguintes dados:
pH = 10,3
pOH = 3,7
E usando as fórmulas para o cálculo do pH e pOH podemos ter o seguinte:
Para o pH:
pH = -log[H3O+]
[H3O+] = 10-pH
Para o pOH:
pOH = -log[OH-]
[OH -] = 10-pOH
Agora vamos substituir os dados:



Resposta: alternativa: A
18 Qual é o pH e pOH de uma solução aquosa de anilina C6H5NH2 0,060M de base, sabendo-se que a sua constante de basicidade é 3,8 ∙ 10-10 ?
A 9,2 e 4,7
B 4,7 e 9,2
C 8,7 e 5,3
D 5,3 e 8,7
Resolução
Dados
[C6H 5NH2 ] = 0,060M
Kb = 3,8 ∙ 10-10
α = ?
Sabemos que:

Como diz-se que é uma base, logo primeiro temos que calcular o pOH e depois o pH :
Neste caso a [OH-] será dada por:
[OH-] = M ∙ α
[OH-] = 0,060 ∙ 7,95 ∙ 10-5
[OH-] = 4,77 ∙ 10-6
Calculando o pOH:
pOH = -log[OH-]
pOH = -log(4,77 ∙ 10-6 )
pOH = 5,3
Agora sim o pH:
pH + pOH = 14
pH + 5,3 = 14
pH = 14 – 5,3
pH = 8,7
Conclusão: pH = 8,7 e pOH = 5,3
Resposta: alternativa: C
19 . Quantos miligramas de hidróxido de sódio (NaOH) estão dissolvidos em 500cm3 de solução de pH = 13,0? (dados: Na = 23; O =16 ; H = 1 u.).
A 2mg
B 20mg
C 200mg
D 2000mg
Resolução
Dados
V = 500cm3 = 0,5L
pH = 13,0
m =?
Como nos dão o pH e a substância que nós temos é uma base, significa que temos que calcular primeiro o pOH dessa base :
pH + pOH = 14
13 + pOH =14
pOH = 14 – 13
pOH = 1
Agora vamos calcular a concentração o OH- usando a fórmula do pOH:
pOH = -log[OH-]
[OH-] = 10-pOH
[OH-] = 10-1
Mr(NaOH) = 23 + 16 + 1 = 40g/mol
Sabemos que a concentração molar é dada por:

E a massa deve estar em miligramas, logo temos que:
1g ---------- 1000mg
2g ----------- 2000mg
Resposta: alternativa: D
20 . O valor do pH de uma solução 0,2M que contém um ácido HA 3% ionizado é...
A 2,00
B 2,11
C 2,22
D 2,25
Resolução
[HA] = 0,2
α = 3% = 0,03
pH = ?
Primeiro calcular a concentração de H+ :
[H+] = M ∙ α
[H+] = 0,2 ∙ 0,03
[H+] = 6 ∙ 10-3
Cálculo do pH
pH = -log[H+]
pH = -log(6 ∙ 10-3 )
pH = 2,22
Resposta: alternativa: C
21 . Qual é o novo pH de uma solução 200mL de HI cujo pH é 1,5 depois de adicionar 250mL de água destilada?
A 0,014
B 1,85
C 9,36
D 12,14
Resolução











0 Comentários