PRÉ-QUÍMICO _______________________________________________________________
Introdução
Kc é a constante de
equilíbrio em função das concentrações (mol/L), sendo definida como o produto das concentrações dos produtos, dividido pelo
produto das concentrações dos reagentes onde cada concentração está elevada a
seu coeficiente estequiométrico da equação química.
A constante de equilíbrio (Kc) pode assumir três valores (3) possíveis, Kc < 1, Kc = 1 e Kc > 1 e qualquer que seja o valor da constante de equilíbrio
(Kc) ele tem um significado e o que nós pretendemos fazer é interpretar esse
significado. O valor de Kc permite-nos por um lado avaliar a tendência ou não
da reacção ocorrer, ou seja, se a reacção é espontânea ou forçada a uma dada
temperatura. A seguir vamos analisar cada caso:
Kc < 1
Consideremos a seguinte equação da reacção genérica:
aA + bB ⇌ cC + dD
Como vemos a expressão de
Kc é uma fracção (basicamente uma divisão) e tratando-se de uma fracção só
temos uma possibilidade para que tenhamos o resultado sendo menor que 1. O que
estamos a querer dizer é que numa fracção o resultado será menor que 1 sempre
que o denominador for maior que o numerador.
No entanto, na expressão
de Kc no denominador ficam os reagentes e no numerador os produtos, assim, estamos
a dizer que Kc
< 1, se o produto (resultado da multiplicação) das concentrações
dos reagentes for maior que o produto das concentrações dos produtos.
Se o produto das
concentrações dos reagentes é maior que o produto das concentrações dos
produtos isso significa obviamente que temos mais reagentes que produtos,
consequentemente, podemos afirmar que neste caso, o equilíbrio encontra-se
deslocado à esquerda (sentido dos reagentes) pois a velocidade da reacção directa é menor a velocidade da reacção inversa, o que podemos
representar:
Notem que uma das setas é mais comprida que a outra justamente para
destacar o facto do equilíbrio estar mais deslocado para a esquerda. E
graficamente podemos representar:
Portanto, quando Kc < 1, o produto das concentrações dos reagentes é
maior que o produto das concentrações dos produtos e o equilíbrio encontra-se
deslocado para a esquerda (lado dos reagentes.).
Kc = 1
Considerando ainda a nossa equação genérica:
aA + bB ⇌ cC + dD
Como vemos a expressão de
Kc é uma fracção (basicamente uma divisão) e numa fracção o resultado é igual a um (1) se o numerador for igual ao denominador. Deste modo
estamos a dizer Kc
= 1 se o produto das concentrações dos produtos é igual ao produto
das concentrações dos reagentes.
Como o produto das concentrações dos reagentes e produtos é igual isso
significa que o equilíbrio não está mais deslocado para nenhum dos lados, ou
seja, decorre com a mesma extensão nos dois sentidos da reacção, o que podemos
representar:
Notem que neste caso as duas setas são do mesmo
tamanho agora, justamente para mostrar que o equilíbrio não está mais deslocado para nenhum dos lados.
Graficamente temos:
Portanto, Kc = 1, quando o produto das concentrações dos reagentes é igual
ao produto das concentrações dos produtos e o equilíbrio não está mais
deslocado para nenhum dos lados, ou seja, decorre com a mesma extensão nos dois
sentidos da reacção.
Kc > 1
Como já sabemos Kc é uma fracção, ou seja, é basicamente a divisão entre as
concentrações dos produtos e reagentes e numa fracção o resultado é maior que 1
se o denominador for menor que o
numerador, ou seja, se o numerador for maior que o denominador. Ora, na
expressão de Kc no numerador ficam os produtos, assim estamos a dizer que Kc > 1
se o produto das concentrações dos produtos for maior que o produto das
concentrações dos reagentes. Se o produto das concentrações dos produtos é
maior que o produto das concentrações dos reagentes isso significa obviamente
que temos mais produtos que reagentes pois a velocidade da reacção directa é
maior que a velocidade da reacção inversa, consequentemente pode-se afirmar que
o equilíbrio encontra-se deslocado mais para a direita (sentido dos produtos),
o que podemos representar pela equação abaixo:
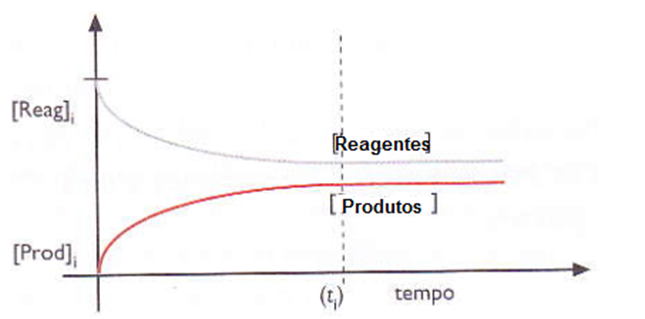
E graficamente temos:
Portanto, quando Kc > 1, o produto das concentrações dos produtos é maior que o produto das concentrações dos reagentes e o equilíbrio encontra-se deslocado para a direita (sentidos dos produtos).
Espontaneidade das reacções
Conforme dissemos acima, valor de Kc
permite-nos avaliar a tendência ou não de uma reacção ocorrer, ou seja, se a
reacção é espontânea ou forçada a uma dada temperatura, deste modo quando:
- Kc > 1 – a reacção é produto favorecido, ou seja, é espontânea;
- Kc = 1 – está em equilíbrio;
- Kc < 1 – a reacção é reagente favorecido, ou seja, não é espontânea, é forçada.
Gráficos: MONJANE, Armindo e CUCO, Ricardo,
Pré-Universitário – Química 12, 1a
ed. Maputo, Longaman Moçambique, 2010.
full-width
















1 Comentários
mt bom
ResponderEliminar