No geral, as
concentrações de iões H+ e OH- nas soluções aquosas são
quantidades muito pequenas e inconvenientes de se trabalhar. Em 1909, Soren
Peter Lauritz Sorensen (1868-1939) propôs uma maneira muito mais prática de
medição chamada de pH (potencial
hidrogeniónico).
O pH é o logaritmo decimal do inverso da concentração em quantidade de matéria de iões H+.
Portanto, o pH é
o logaritmo da concentração de iões H+ em mol/L, com sinal negativo.
pH = – log[H+] ou pH = – log[H3O+]
Da mesma forma, o pOH (potencial hidroxiliónico) é o logaritmo da
concentração de iões OH- em mol/L, com sinal negativo.
pOH = – log[OH–]
Nas equações
acima, os termos [H+] ou [H3O+] e [OH–]
dizem respeito somente a parte numérica dessas concentrações uma vez que não se
pode aplicar o logaritmo a unidades. Portanto, o pH e pOH são adimensionais,
isto é, não têm unidades.
Se aplicarmos o antilogaritmo as equações
anteriores teremos:
pH = – log[H+] ⇒ [H+] = 10–pH ou [H3O+]
= 10–pH
pOH = – log[OH–]
⇒ [OH–] = 10–pOH
Portanto, é
possível a partir dos valores de pH e pOH calcularmos respectivamente as
concentrações de iões H+ e OH-.
Agora podemos
aplicar os conceitos de pH e pOH numa situação mais prática. Anteriormente
vimos que:
⦁ Solução neutra: [H+] = [OH-] = 1,0 x 10-7
mol/L
⦁ Solução ácida: [H+] > [OH-] ⇒ [H+] > 1,0 x 10-7
mol/L
⦁ Solução básica: [H+] < [OH-] ⇒ [H+] < 1,0 x 10-7
mol/L
No entanto, a
forma mais conveniente de expressar estes valores é através do pH.
⦁ Solução neutra: –log[H+] = –log[OH-] = –log (1,0
x 10-7) ⇒ pH = pOH = 7
⦁ Solução ácida: log[H+] > log[OH-] ⇒ –log[H+] < –log(1,0
x 10-7) ⇒ pH < 7
⦁ Solução básica: log[H+] < log[OH-] ⇒ –log[H+] > –log(1,0
x 10-7) ⇒ pH > 7
Devido ao sinal menos (–) que aparece em frente do logaritmo, a escala de
pH segue um sentido contrário ao da concentração de iões H+.
Isso significa que quanto mais ácida for a solução, maior é a concentração
de iões H+, porém, menor será o valor de pH.
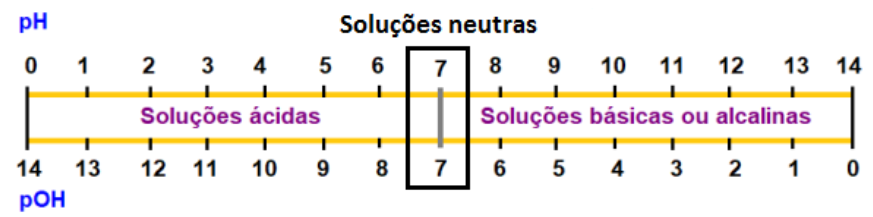
A escala de pH expressa o grau de acidez ou basicidade de uma solução de forma numérica com valores que variam de 0 a 14, a 25oC.
Os valores de pH
menores que 7 indicam que a solução é ácida. O valor 7, isto é, pH = 7 indica
que a solução é neutra, ou seja, que a solução não tem propriedades ácidas e
nem básicas. Já os valores de pH maiores que 7 indicam que a solução é básica
ou alcalina.
Nos extremos
desta escala temos os valores 0 e 14. O pH = 0 indica que o grau de acidez é
máximo enquanto o pH = 14 indica que o grau máximo de basicidade.
Visto que a
escala de pH é logarítmica, uma variação de uma unidade de pH corresponde a uma
variação de dez vezes na concentração de iões H+.
A escala de pOH
expressa o grau de acidez ou basicidade de uma solução de forma numérica com
valores que variam de 0 a 14, a 25oC.
Os valores de pOH menores que 7 indicam que a solução é básica ou alcalina. O valor 7, isto é, pOH = 7 indica que a solução é neutra, ou seja, que a solução não tem propriedades ácidas e nem básicas. Já os valores de pOH maiores que 7 indicam que a solução é ácida.
Consideremos o produto iónico da água a 25°C: [H+] ∙ [OH-] = 1,0 ∙ 10-14
Vamos aplicar o
logaritmo em ambos lados da equação e depois multiplicaremos por – 1:
log([H+]
∙ [OH–]) = log(1,0 ∙ 10-14)
log [H+]
+ log [OH–] = log 1 + log 10–14
log [H+]
+ log [OH–] = – 14
log [H+]
+ log [OH-] = – 14 ∙ (– 1)
– log [H+] – log [OH-] = 14
pH + pOH = 14
A última
expressão é válida a 25°C e relaciona o pH e o pOH, de modo que tendo um determinado valor de pH pode-se
determinar o valor de pOH e vice-versa.
Por: MiguelPascoal
*Créditos a
imagem: pH-metro: TP
Laboratório Químico











0 Comentários