O pH DE
SOLUÇÕES SALINAS
Os ácidos e as bases são substâncias que têm a capacidade de alterar o pH
do meio quando dissolvidos em água. No entanto, a experiência mostra que além
dos ácidos e das bases, alguns sais devido à natureza dos ácidos e bases que os
deram origem, quando dissolvidos em água alteram igualmente o pH do meio.
O fenómeno da dissociação de sais e que provocam a alteração no pH é conhecido
como hidrólise. Assim, a hidrólise
pode ser entendida como uma reacção ácido-base na qual um ião derivado do sal
interage com a água provocando o aumento da concentração de iões hidrónio (H3O+)
ou iões hidroxilo (OH-).
Portanto, o pH de uma solução salina depende dos iões presentes nessa
solução. De um modo geral podemos ter o seguinte:
• Iões provenientes de sal de ácidos e bases fortes, não sofrem hidrólise,
consequentemente não alteram o pH do meio, mantendo-se assim a solução neutra
(pH =7).
• Soluções de sais provenientes de ácidos fortes e bases fracas têm
carácter ácido (pH < 7) devido à hidrólise do catião que provoca o aumento
da concentração de iões hidrónio (H3O+) ou iões
hidrogénio (H+);
• Soluções de sais provenientes de ácidos fracos e bases fortes têm
carácter básico (pH > 7) devido à hidrólise do anião que provoca o aumento
da concentração de iões hidroxilo (OH-);
• No caso de soluções de sais provenientes de ácidos e bases fracos, o pH da solução depende da força relativa do anião e do catião. Quando Ka > Kb, a solução é ácida; Ka = Kb, a solução é neutra e no caso de Ka < Kb a solução é básica.
CÁLCULO DO pH
DE SOLUÇÕES SALINAS
O cálculo do pH de soluções salinas é idêntico ao cálculo do pH de ácidos e
bases fracos. Para efectuarmos o cálculo do pH de soluções salinas é importante
seguirmos os seguintes passos:
1o: Escrever a equação de dissociação do sal e relacionar a
concentração do sal com os iões em solução;
2o: Analisar a natureza dos iões para se verificar qual deles
sofre hidrólise;
3o: Escrever o equilíbrio (equação da reacção) envolvido na
hidrólise e identificar o carácter químico da solução verificando se durante a
hidrólise formou-se iões H3O+ ou OH-;
4o: Usar uma tabela de concentrações;
5o: Escrever a expressão da constante de hidrólise, fazer a
substituição dos dados e resolver.
EXEMPLO:
(UEM – 2022) O
pH de uma solução 1,0 mol/L de NH4Cl, a 25oC é:
(Dados: Kb = 1,8 · 10-5; log 2,36 = 0,37)
A 1,00 B 4,63
C 9,38 D 1,37
E 0,18
RESOLUÇÃO
Vamos seguir os passos descritos acima:
1o:
Escrever a equação de dissociação do sal e relacionar a concentração do sal com
os iões em solução
Este sal (NH4Cl) em solução aquosa dissocia-se completamente
segundo a equação da reacção:
NH4Cl(aq) → NH4+(aq) + Cl-(aq)
1 mol 1 mol 1 mol
Uma vez dissociado completamente, a concentração de NH4Cl é directamente proporcional aos coeficientes estequiométricos dos iões em solução:
NH4Cl(aq) → NH4+(aq)
+
Cl-(aq)
1 mol/L 1 mol/L 1 mol/L
Portanto, a concentração inicial de NH4+
e Cl- é de 1 mol/L.
2o:
Analisar a natureza dos iões para se verificar qual deles sofre hidrólise
A equação de dissociação mostra-nos que formou-se dois iões,
o ião amónio (NH4+) e o ião cloreto (Cl-). O
ião Cl- é proveniente de um ácido forte (HCl) por isso não sofre
hidrólise. O ião amónio (NH4+) provém de uma base fraca
(NH3) por isso sofre hidrólise.
3o:
Escrever o equilíbrio (equação da reacção) envolvido na hidrólise e identificar
o carácter químico da solução verificando se durante a hidrólise formou-se iões
H3O+ ou OH-
O ião que sofre hidrólise é o amónio (NH4+)
cujo equilíbrio envolvido nessa hidrólise é descrito pela equação da reacção a
seguir:
NH4+ + H2O ⇌ NH3 + H3O+
Na
hidrólise deste ião gerou-se o ião hidrónio (H3O+) por isso
a solução terá carácter ácido, portanto, o pH deve ser menor que 7 (pH < 7).
4o:
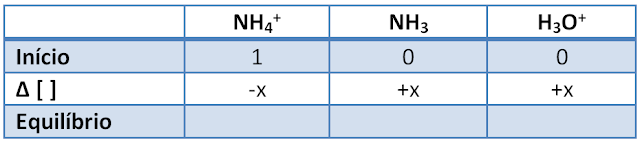
Usar uma tabela de concentrações
A
tabela mostra três situações, o início, as variações das concentrações e o equilíbrio:
• Conforme vimos no 1o
passo, a concentração inicial de NH4+ é de 1 mol/L. No início ainda não temos os produtos razão pela qual a concentração de NH3 e H3O+
é nula, isto é, igual a zero.
• Durante a reacção, os reagentes são consumidos e os produtos são formados. Como não sabemos o quanto de reagente é consumido e de produtos é formado, vamos considerar “-x” a quantidade consumida do reagente e “+x” as quantidades dos produtos que se formaram.
• As concentrações no equilíbrio podem ser determinadas da seguinte
maneira:
Reagentes: quantidade inicial – quantidade consumida (∆[ ])
Produtos: quantidade inicial + quantidade formada (∆[ ])
Portanto,
5o:
Escrever a expressão da constante de hidrólise, fazer a substituição dos dados
e resolver.
Para escrever a expressão da constante
de hidrólise precisamos ter a respectiva a equação:
NH4+ + H2O ⇌ NH3 + H3O+
Observamos que na hidrólise de NH4+
formou-se o H3O+, portanto, esta constante de hidrólise é
na prática a constante de acidez do ião amónio.
Agora, notem que o exercício nos fornece o Kb (constante
de basicidade) e nós acabamos de dizer que a constante de hidrólise de NH4+
é uma constante de acidez do NH4+, assim precisamos de
calcular o valor da constante de hidrólise primeiro.
Para tal usaremos a relação que vimos quando falámos da constante de hidrólise que é:
Como sabemos a 25oC, Kw é igual a 1
· 10-14 M2. O valor de Kb já temos então podemos
determinar Kh:
Vamos continuar resolvendo:
Logo, [H3O+] = x= 2,36 · 10-5
M
Tendo a concentração de iões H3O+
vamos calcular o pH da solução:
pH = –log[H3O+]
pH = –log(2,36 · 10-5)
pH =
–(log 2,36 + log 10-5)
pH =
–(0,37 – 5)
pH =
–0,37 + 5
pH = 4,63
Resposta: alternativa: B
EXERCÍCIO
RESOLVIDO
(UP –
2022) O pH de uma solução de Al(NO3)3 a 2,5 · 10-5
mol/L (Ka[Al(H2O)6]3+ = 1,4 · 10-5
mol/L é:
A 4,8539 B 4,7280 C
4,6021 D 1,87 · 10-5
RESOLUÇÃO
Equação de dissociação:
Al(NO3)3(aq) → Al3+(aq) +
3
2,5 · 10-5 2,5 · 10-5 3·(2,5 · 10-5)
O ião Al3+ existe em meio aquoso na verdade
sob a forma de ião complexo [Al(H2O)6]3+e tem
comportamento de um ácido:
[Al(H2O)6]3+(aq) + H2O(l) ↔ [Al(H2O)5OH]2+(aq)
+ H3O+(aq)
Usando uma tabela:
Concentração de iões H+
Cálculo do pH
pH = -log[H3O+]
pH = -log(1,870828693 ∙ 10-5 M)
pH = 4,72796
pH ≈ 4,7280
Resposta: alternativa: B
Por: Miguel Pascoal




















0 Comentários