RESOLUÇÃO DO EXAME
DE ADMISSÃO DE QUÍMICA I – UEM 2023
Analise os processos em
relação à cinética química.
I. Quando o carvão está
iniciando a sua queima, as pessoas ventilam o sistema para que a queima se propague
mais rapidamente.
II. Um comprimido
efervescente se dissolve mais rapidamente quando triturado.
Assinale a alternativa que contém os factores que
influenciam as velocidades das reacções químicas nos processos descritos em I e
II, respectivamente:
A Concentração, superfície de contacto.
B Catalisadores, concentração.
C Temperatura, concentração
D Superfície de contacto, catalisador.
E Temperatura, catalisador.
RESOLUÇÃO
Os factores que influenciam a
velocidade de uma reacção química são a concentração dos reagentes, a temperatura, a superfície de contacto, a natureza dos reagentes e o catalisador.
Análise dos itens:
I. A queima do carvão consiste basicamente na reacção entre
o Carbono (o carvão é basicamente Carbono) e o Oxigénio. Assim, quando as
pessoas ventilam este sistema o que acontece é que vão aumentando cada vez mais
a quantidade de Oxigénio o que faz com que a queima se propague mais
rapidamente. Portanto, esta ventilação a que se refere o exercício é nada mais
nada menos que o aumento da concentração de
Oxgénio (um dos reagentes nesse processo de combustão), logo, neste
processo fala-se do factor concentração dos
reagentes.
II. A trituração de um comprimido efervescente permite a
diminuição do tamanho do comprimido. O grau de divisão das partículas está
relacionado à superfície de contacto. A superfície de contacto é a área
disponível num reagente para ele puder entrar em contacto com o outro reagente.
Quanto maior for esta área maior será a superfície de contacto e
consequentemente maior é a velocidade da reacção. Portanto, neste processo
fala-se da superfície de contacto.
Conclusão: I – concentração; II – superfície de contacto.
Resposta: alternativa: A
42. Considere a reacção: M(g) + N(g) → O(g)
Observa-se
experimentalmente que, duplicando-se a concentração de N, a velocidade de
formação de O quadruplica; e, duplicando-se a concentração de M, a velocidade
da reacção não é afectada. A equação da
velocidade V dessa reacção é:
A V =k[M]2
B V =k[N]2
C V =k[M]
D V =k[M][N]
E V =k[M][N]2
RESOLUÇÃO
Sabe-se que a
velocidade da reacção é directamente proporcional à concentração dos reagentes.
Se a velocidade de formação de O (velocidade da reacção) quadruplica (aumenta 4
vezes) quando duplica-se a concentração de N isso significa que a velocidade da
reacção é directamente proporcional ao quadrado da concentração de N, ou seja,
[N] está elevada ao expoente 2, [N]2.
Se a velocidade
da reacção não é afectada quando se duplica a concentração de M quer dizer que
a velocidade da reacção não depende do reagente M, portanto, M não tem
influência na velocidade da reacção. Assim, M não aparece na expressão da lei
de velocidade.
Portanto, a
expressão da lei de velocidade é:
V = k[N]2
Se a velocidade
da reacção não é afectada quando se duplica a concentração de M quer dizer que
a velocidade da reacção não depende do reagente M, portanto, M não tem
influência na velocidade da reacção, logo a ordem da reacção em relação ao
reagente M é zero, [M]0. Assim, M não aparece na expressão da lei de
velocidade.
Portanto, a
expressão da lei de velocidade é:
V = k[M]0[N]2
⇔ V = k[N]2
Vamos demonstrar isso:
A expressão geral
da lei de velocidade pode ser escrita como:
V = k[M]a[N]b
Ordem do reagente M
Temos que manter o N constante:
V1 = k[M]a
A velocidade da
reacção não se altera quando a concentração de M duplica:
V1 = k(2[M])a ⇒ V1 = k ·2a · [M]a
Portanto, V = k[M]a ⇒ V = k[M]0 ⇒ V = k
Obs: Todo número diferente
de zero com expoente zero é igual a 1: a0 =
1.
Ordem do reagente N
Temos que manter o M constante:
V1 = k[N]b
A velocidade da
reacção quadruplica (aumenta 4 vezes) quando a concentração de N duplica:
4V1 = k(2[N])b ⇒ 4V1 = k ·2b · [N]b
Portanto, V =
k[N]b ⇒ V = k[N]2
Assim, a
expressão da lei de velocidade é:
V = k[N]2
Resposta: alternativa: B
43. Considere uma reacção genérica em que os reagentes D e G
transformam-se no produto J. A cinética dessa reacção pode ser estudada a
partir do gráfico abaixo que representa a entalpia de reagentes e produtos, bem
como das espécies intermediárias formadas durante o processo. No gráfico, estão
representados os caminhos da reacção na presença e na ausência de catalisador.
Um aluno ao analisar esse gráfico fez algumas afirmações a respeito da
reacção: D + G → J:
I. z representa a variação de entalpia (∆H) dessa reacção.
II. y representa a energia de activação dessa reacção na presença de
catalisador.
III. x + z representa a energia de activação dessa reacção na ausência de
catalisador.
IV. Essa reacção corresponde a um processo endotérmico.
Estão correctas apenas
as afirmações:
A. I e II
B. I e III
C. II e III
D. II e IV
E. I, II e IV
RESOLUÇÃO
Para resolvermos
correctamente este exercício, temos que definir alguns conceitos básicos.
⦁ Variação de entalpia (∆H) é a medida da
quantidade de calor libertada ou absorvida numa reacção química a pressão
constante.
∆H = ∑Hprodutos
–
∑Hreagentes
Portanto, a variação de
entalpia corresponde à diferença entre o conteúdo energético dos produtos e
reagentes.
⦁ Energia de activação (Ea) –
é a menor quantidade de energia (energia mínima) que deve ser fornecida aos
reagentes para a formação do complexo activado e, consequentemente, para a
ocorrência da reacção.
A energia de activação corresponde à diferença entre a energia do complexo
activado e a energia dos reagentes:
Ea = energia do complexo activado (Ca) – energia dos
reagentes (Hreagentes)
Agora vamos analisar o gráfico fornecido pelo exercício:
Portanto, temos:
D + G – são os reagentes e estes têm certa energia (Hreagentes);
J – é o produto e este também certa energia (Hprodutos);
Ca1 – é o complexo activado da reacção sem catalisador;
Ca2 – é o complexo
activado da reacção com catalisador;
Ea1 – energia de activação da reacção sem catalisador;
Ea2 – energia de activação da reacção com catalisador;
Análise dos itens:
I. CORRECTO
Como se pode ver, o “z”
representa a diferença entre a energia dos produtos e reagentes, o que
corresponde à variação de entalpia (∆H) da reacção;
II. CORRECTO
A energia de activação
corresponde à diferença entre a energia do complexo e a energia dos reagentes,
tal como mostra o gráfico. Veja que o “x” também representa a energia de
activação, mas veja que a energia de activação representada pelo “y” é bem que
menor que aquela representada por “x” logo, o “y” representa sim a energia de
activação da reacção na presença de catalisador (pois o catalisador diminui a
energia de activação).
III. INCORRECTO
Note que o “y” está
incluído na energia de activação representada por “x” e este “x” representa a
energia de activação na ausência de catalisador, logo x + y é que representa a energia de activação na ausência de
catalisador.
Ora, o “z” representa a
entalpia da reacção (∆H), porém, a energia de activação é a
diferença entre a energia do complexo activado e a ENERGIA DOS REAGENTES (Hreagentes).
IV. INCORRECTA
Veja que pelo gráfico,
notamos que a energia dos produtos é menor que a energia dos reagentes, ainda
assim: Sabe-se que a
variação de entalpia (∆H) de uma reacção é dada por: ∆H = ∑Hprodutos – ∑Hreagentes
.
Assim, se o
somatório das entalpias dos produtos (∑Hprodutos) é menor significa
que a diferença:
∑Hprodutos – ∑Hreagentes será um valor
negativo.
Logo, teremos: ∑Hprodutos <
∑Hreagentes ⇒ ∑Hprodutos
– ∑Hreagentes < 0 ⇒ ∆H < 0.
Mas também, podemos analisar os perfis dos seguintes gráficos:
Portanto, a reacção é exotémica (trata-se de um
processo exotérmico).
Conclusão: itens correctos: I e II.
Resposta: alternativa: A
44. Das alternativas apresentadas abaixo, qual pode
aumentar a quantidade de O2 no equilíbrio traduzido pela reacção: 2
NO(g) + O2(g) ⇌ 2 NO2(g) ∆H < 0.
A Adição de NO ao sistema
B Remoção de NO2 do sistema
C Aumento da temperatura
D Diminuição do volume, ou seja, aumento da pressão.
E Adição de um catalisador ao sistema.
RESOLUÇÃO
Vamos escrever a equação
da reacção em equilíbrio:
2 NO(g) + O2(g)
⇌ 2 NO2(g) ∆H
< 0
Por se tratar de uma
reacção em equilíbrio, para que possamos aumentar a quantidade de O2
temos que deslocar o equilíbrio à
esquerda. Então vamos analisar cada alternativa.
A INCORRECTA
A equação da reacção
mostra-nos que NO é um reagente (na reacção directa), assim, se aumentarmos a
concentração de NO, o equilíbrio irá se deslocar
para a direita e com isso haverá o consumo de NO e de O2,
portanto, a quantidade de Oxigénio irá diminuir.
B INCORRECTA
O NO2 é um
produto, a sua remoção fará com que o equilíbrio se desloque para a direita justamente para repor as quantidades de
NO2 que terão sido removidas.
C CORRECTA
A variação de entalpia
(∆H) da reacção é menor do que zero logo a reacção directa é exotérmica,
consequentemente a reacção inversa é endotérmica. Para facilitar a compreensão
vamos escrever de forma separada as equações das reacções directa e inversa.
Reacção directa: 2 NO(g)
+ O2(g) → 2 NO2(g)
∆H < 0 (reacção exotérmica)
Reacção inversa: 2 NO2(g)
→ 2 NO(g) + O2(g) ∆H > 0 (reacção endotérmica)
Ora, num sistema em
equilíbrio, o aumento da temperatura desloca o equilíbrio no sentido da reacção
endotérmica. Neste caso na reacção
inversa (que é endotérmica) o O2 é o produto, assim, se
aumentarmos a temperatura o equilíbrio deslocar-se-á no sentido de formar mais
NO e O2, portanto, as quantidades de NO e O2 irão
aumentar.
D INCORRECTA
O aumento da pressão num
sistema em equilíbrio desloca o equilíbrio no sentido de menor quantidade de
matéria (menor volume). Vejamos:
2 NO(g) + O2(g)
⇌ 2 NO2(g)
∑coeficientes
estequiométricos dos reagentes gasosos: 2 mol NO + 1 mol O2 = 3 mol de reagentes
∑coeficientes
estequiométricos dos produtos gasosos: 2 mol NO2
Como se vê, o lado onde
temos a menor quantidade de matéria é o lado direito, logo, o aumento da pressão
irá provocar o deslocamento de equilíbrio para a direita favorecendo o consumo
de NO e O2, portanto, a diminuição da quantidade de Oxigénio.
E INCORRECTA
O Catalisador não afecta
os sistemas em equilíbrio visto que este aumenta igualmente as velocidades das
reacções directa e inversa, fazendo com que o estado de equilíbrio seja
alcançado rapidamente.
Resposta: alternativa: C
45. Um mol de hidrogénio é misturado com um mol de iodo num
recipiente de um litro a 500oC, onde se estabelece o equilíbrio H2(g)
+ I2(g) ⇌ 2 HI(g). Se
o valor da constante de equilíbrio (Kc) for 49, a concentração de HI
no equilíbrio em mol/litro será de:
A 1/9
B 14/9
C 2/9
D 7/9
E 11/9
RESOLUÇÃO
Uma vez tendo o valor da constante de equilíbrio (Kc = 49) e as quantidades iniciais dos reagentes o que será feito primeiro é calcular as concentrações em mol/L de H2 e I2.
Vamos usar uma tabela:
H2(g) + I2(g) ⇌ 2HI(g)
• A concentração inicial
de HI é nula, pois é um produto e ainda não se formou nada;
• Consideramos “-x” as
variações da concentração de H2 e I2, pois estes são
consumidos durante a reacção e pela equação da reacção temos 1 mol de H2
e 1 mol de I2. A variação da concentração de HI é +2x. O “2” deve-se
ao facto de termos 2 mol de HI como mostra a equação da reacção.
Escrever a expressão da constante de equilíbrio e substituir os dados:
Na última expressão podemos aplicar a raíz quadrada em ambos os lados para simplicarmos esta expressão:
Então a
concentração de HI no equilíbrio é:
[HI] = 2x ⇒ [HI] = 2 · 7/9 ⇒ [HI] = 14/9
mol/L
Resposta: alternativa: B
46. O deslocamento
para a esquerda, do equilíbrio 2 H2(g) + O2(g) ⇌ 2 H2O(g),
provoca:
A Aumento da concentração de H2O(g)
B Diminuição da concentração de H2(g)
C Diminuição da
concentração de O2(g)
D Aumento da concentração
de H2(g)
E Manutenção da
concentração de H2O(g)
RESOLUÇÃO
Vamos escrever a equação da reacção em equilíbrio:
2 H2(g) + O2(g) ⇌ 2 H2O(g)
Neste sistema em equilíbrio, o deslocamento do equilíbrio para a esquerda
vai provocar a diminuição da
concentração de H2O, pois a reacção que estará
a se processar será a reacção inversa (na qual H2O é o reagente),
consequentemente as concentrações de H2 e O2 irão
aumentar visto que estas substâncias estarão a ser formadas.
Resposta: alternativa: D
47. Dados os equilíbrios
químicos abaixo:
I. 2 O3(g) ⇌ 3 O2(g)
II. H2O(g)
+ C(s) ⇌ H2(g) + CO(g)
III. 4 NH3(g)
+ 5 O2(g) ⇌ 4 NO(g) + 6 H2O(g)
IV. Cl2(g) ⇌ 2 Cl(g)
V. CaCO3(s) ⇌ CaO(s) + CO2(g)
Em quais destes equilíbrios a compressão (redução do
volume do reactor) favorece a reacção directa?
A I, III e IV
B II e IV
C I e IV
D Todos
E Nenhum
RESOLUÇÃO
Primeiro vamos definir os conceitos de reacção directa e reacção inversa.
A reacção que ocorre da esquerda para a
direita, ou seja, no sentido de formação dos produtos é designada de reacção directa e a reacção que se
processa no sentido contrário, isto é, da direita para a esquerda (sentido de
formação de reagentes) recebe o nome de reacção
inversa.
Agora recordemos
que a pressão e o volume são grandezas inversamente proporcionais à temperatura
constante, o que significa que a diminuição
do volume implica o aumento da
pressão e vice-versa. No caso deste exercício diz-se que há redução do volume, portanto, ocorre o
aumento da pressão, por isso analisaremos
cada um dos itens olhando para o aumento da pressão sobre estes sistemas em
equilíbrio.
A variação da pressão vai
afectar apenas substâncias que estejam no estado gasoso. Para que se possa
avaliar o efeito da variação da pressão no deslocamento do equilíbrio no
sistema deve haver substâncias no estado gasoso. Neste caso temos que somar os
coeficientes estequiométricos de todos os participantes que estejam no estado
gasoso na equação da reacção nos reagentes e nos produtos. Assim teremos 3
casos possíveis:
⦁ Caso o somatório dos
coeficientes estequiométricos dos reagentes no estado gasoso seja maior que o somatório dos
coeficientes estequiométricos dos produtos no estado gasoso, o aumento da
pressão irá provocar o deslocamento do equilíbrio no sentido dos produtos
(formação dos produtos);
⦁ Caso o somatório dos
coeficientes estequiométricos dos reagentes no estado gasoso seja igual ao somatório dos
coeficientes estequiométricos dos produtos no estado gasoso, a variação da
pressão não afecta o equilíbrio.
⦁ Caso o somatório dos
coeficientes estequiométricos dos reagentes no estado gasoso seja menor que o somatório dos
coeficientes estequiométricos dos produtos no estado gasoso, o aumento da
pressão irá provocar o deslocamento do equilíbrio no sentido dos reagentes;
Portanto, sabe-se que num sistema em equilíbrio, o
aumento da pressão desloca o equilíbrio no sentido de menor quantidade de
matéria ou número de moles (sentido de menor volume). A diminuição da pressão
desloca o equilíbrio no sentido de maior quantidade de matéria ou número de
moles (sentido de maior volume).
Vamos analisar cada um dos itens apresentados:
I. 2 O3(g) ⇌ 3 O2(g)
⦁ Número de moles
dos produtos gasosos: 3 mol O2
⦁ Número de moles
dos reagentes gasosos: 2 mol O3
Como se pode ver temos
menor quantidade de matéria no lado dos reagentes, logo, o equilíbrio irá se
deslocar no sentido inverso, ou seja, no sentido da reacção inversa (formação
de O3).
II. H2O(g) + C(s) ⇌ H2(g) + CO(g)
⦁ ∑coeficientes dos
estequiométricos dos produtos gasosos [∑n(produtos)]: 1 mol H2 +
1 mol CO = 2 mol
⦁ ∑coeficientes
estequiométricos dos reagentes gasosos [∑n(reagentes)]: 1 mol H2O = 1 mol
Portanto, ∑n(produtos) > ∑n(reagentes) ⇒ Desloca-se para esquerda,
sentido da reacção inversa.
III. 4 NH3(g) + 5 O2(g) ⇌ 4 NO(g) + 6 H2O(g)
⦁ ∑ Coeficientes
estequiométricos dos produtos gasosos [∑n(produtos)]: 4 mol NO + 6 mol H2O
= 10 mol
⦁ ∑ Coeficientes
estequiométricos dos reagentes gasosos [∑n(reagentes)]: 4 mol NH3 + 5 mol O2 =
9 mol
Portanto, ∑n(produtos) > ∑n(reagentes) ⇒ Desloca-se para
esquerda, sentido da reacção inversa.
IV. Cl2(g) ⇌ 2 Cl(g)
⦁ ∑ Coeficientes
estequiométricos dos produtos gasosos [∑n(produtos)]: 2 mol Cl = 2 mol
⦁ ∑ Coeficientes
estequiométricos dos reagentes gasosos [∑n(reagentes)]: 1 mol Cl2 = 1 mol
Portanto, ∑n(produtos) > ∑n(reagentes) ⇒ Desloca-se para
esquerda, sentido da reacção inversa.
V. CaCO3(s) ⇌ CaO(s) + CO2(g)
⦁ ∑ Coeficientes estequiométricos
dos produtos gasosos [∑n(produtos)]: 1 mol CO2 = 1 mol
⦁ ∑ Coeficientes
estequiométricos dos reagentes gasosos [∑n(reagentes)]: 0 mol
Portanto, ∑n(produtos) > ∑n(reagentes) ⇒ Desloca-se para
esquerda, sentido da reacção inversa.
Resposta: alternativa: E
48. Ao analisar um
determinado sumo de tomate, um técnico determinou que sua concentração de
hidrogénio é igual a 0,001 mol/L. O pH desse sumo de tomate é:
A 2
B 3
C 4
D 9
E 11
RESOLUÇÃO
Dado: [H+] = 0,001 mol/L ou [H+] = 1 ∙ 10-3
mol/L
Pedido: pH = ?
O pH pode ser calculado através da seguinte fórmula: pH = – log[H+]
pH = – log[H+]
pH = – log(1 ∙ 10-3)
pH = – (log 1 +
log 10-3)
pH = – (0 – 3)
pH = 3
Resposta: alternativa: B
49. Para preparar 1,2 litros de solução 0,4 M de HCl, a partir do ácido
concentrado (16 M), o volume de água, em litros, a ser utilizado será de:
A 0,03
B 0,47
C 0,74
D 1,03
E 1,17
RESOLUÇÃO
Este exercício trata da diluição, que consiste na adição de um solvente a uma solução com a finalidade de reduzir a sua concentração. Primeiro teremos que calcular o volume inicial, ou seja, o volume da solução concentrada (16 M) que foi usado na diluição e por fim o volume da água tal como pede o exercício.
Resposta: alternativa: E
50. Na temperatura ambiente, a constante de ionização do
ácido acético é 1,80 x 10-5. Qual
é a molaridade da solução onde o ácido se encontra 3% dissociado?
A 2,00 x 10-2 molar
B 3,00 x 10-2 molar
C 5,82 x 10-4
molar
D 5,40 x 10-5 molar
E 6,00 x 10-7 molar
RESOLUÇÃO
Dados:
α = 3%
Ka =
1,8 x 10-5.
Pedido: Calcular a concentração molar ou molaridade
(M) = ?
Visto que α <
5%, ou seja, 3% < 5%, significa que o ácido é fraco pelo que a constante de
dissociação do ácido pode ser calculada através da seguinte expressão:
Ka = M · α2
O grau de
dissociação ou ionização (α) é de 3% e a constante de ionização do ácido é 1,8
x 10-5.
Atenção ao facto
de que “α” não pode ser usado em termos percentuais sendo por isso necessário
dividir o valor dado em termos percentuais por 100%:
α = 3% / 100% ⇒ α = 0,03 ou α = 3
∙ 10-2
A partir da fórmula do cálculo da constante de ionização do ácido vamos isolar a concentração molar M.
Na última expressão podemos substituir os dados e realizar os devidos cálculos:
Resposta: alternativa: A
GOSTOU DESTA RESOLUÇÃO E QUERIA TER ACESSO A VERSÃO COMPLETA? CLIQUE AQUI PARA COMPRAR A RESOLUÇÃO COMPLETA DESTE EXAME EM PDF OU CONTACTE 846767922.
Por: Miguel Pascoal
Licenciado em Ensino de Química
FIM



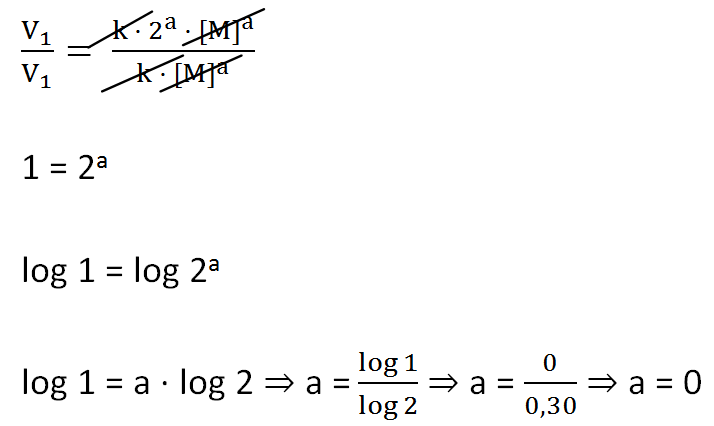
















3 تعليقات
👏👏
ردحذفBom dia pra si ilustre! Gostaria de em primeiro lugar desejar que tenha vida longa, saúde e prosperidade!
ردحذفAprecio muito o excelente trabalho que está a fazer, até então, nunca vi melhor publicado com tamanha lógica e sabedoria. Espero que continue a ajudar a todos os interessados nos exames de admissão do chamado de "bicho de sete cabeças" a química.
Atenciosamente, Edson Eninho.
Saudações!
ردحذفPrefiro arriscar que não existe outro melhor em Moçambique 🇲🇿, do que o Pré-QUÍMICO. Sucessos para você em tudo!👏👏👏