Para a determinação do número de oxidação dos átomos que estejam efectuando ligações covalentes como é o caso dos átomos que constituem os compostos orgânicos é fundamental ter-se em conta o conceito de electronegatividade (a tendência que os átomos têm de atrair para si os electrões envolvidos numa ligação química).
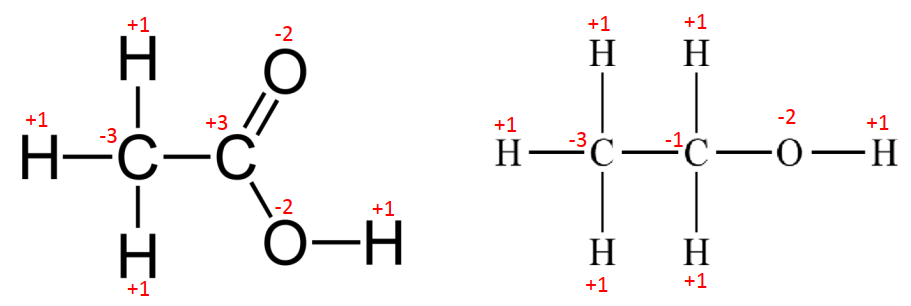
Analisemos o composto em (a), Ácido acético.
Como se vê, temos
um átomo de Carbono ligado a três átomos de Hidrogénio, no entanto, o Hidrogénio
é menos electronegativo que o Carbono por isso os electrões envolvidos nessas
ligações são atraídos com mais “força” para o átomo de Carbono tal como as
setas azuis indicam. Assim, o que acontece é como se cada átomo de Hidrogénio “tivesse perdido” um electrão e o Carbono
“tivesse ganho”, ao todo são três
electrões por isso neste caso, cada átomo de Hidrogénio tem nox igual a +1 e o
Carbono nox = -3. A ligação C – C não a levaremos em conta visto que os átomos
envolvidos são do mesmo elemento químico, por isso têm mesma
electronegatividade.
Analisando ainda
a molécula do Ácido Acético, notamos que o outro átomo de Carbono estabelece
uma dupla ligação com o átomo de Oxigénio e estabelece ainda uma ligação
simples com outro átomo de Oxigénio. O Oxigénio é mais electronegativo que o
Carbono por isso “puxa” para si os electrões envolvidos nessa ligação. Desta
feita, na dupla ligação o que acontece é como se o carbono “tivesse perdido” um electrão em cada uma
dessas duas ligações, portanto, é como se “tivesse
perdido dois electrões” e na ligação simples acontece o mesmo pois
imaginamos que Carbono tenha “perdido um
electrão” para o Oxigénio como mostram as setas vermelhas.
Assim, o Carbono
ao todo “perdeu” para o Oxigénio três electrões por isso esse átomo de Carbono
tem neste caso nox igual +3. No entanto, o átomo de Oxigénio ligado a esse
Carbono tem nox igual a -2 pois teoricamente “ganha” dois electrões do Carbono.
Por fim, o átomo Oxigénio ligado ao Carbono e ao Hidrogénio simultaneamente tem
nox igual a -2 pois “aparentemente recebe”
um electrão do Carbono e outro electrão do Hidrogénio e o Hidrogénio tem nox
igual a +1 visto que “aparentemente cede”
o seu electrão ao Oxigénio.
Analisemos o composto em (b), Etanol.
Temos um átomo de
Carbono ligado a três átomos de Hidrogénio, no entanto, o Hidrogénio é menos
electronegativo que o Carbono por isso os electrões envolvidos nessas ligações
são atraídos com mais “força” para o átomo de Carbono tal como as setas azuis
indicam. Assim, o que acontece é como se cada átomo de Hidrogénio “tivesse perdido” um electrão e o Carbono
“tivesse ganho”, ao todo são três
electrões por isso neste caso, cada átomo de Hidrogénio tem nox igual a +1 e o
Carbono nox = -3. A ligação C – C não a levaremos em conta visto que os átomos
envolvidos são do mesmo elemento químico por isso têm mesma
electronegatividade.
No segundo átomo
de Carbono, o que acontece é como se cada átomo de Hidrogénio “tivesse perdido um electrão” e o Carbono
“tivesse ganho”, ao todo o Carbono “teoricamente ganha” dois electrões por
isso neste caso cada átomo de Hidrogénio tem nox igual a +1 e o Carbono tem “nox = -2”. A ligação C – C não a
levaremos em conta, visto que os átomos envolvidos são do mesmo elemento
químico, por isso têm mesma electronegatividade. Porém, acontece que este
segundo átomo de Carbono também está ligado a um átomo de Oxigénio e este
último é mais electronegativo que o Carbono por isso “teoricamente o C perde” para o Oxigénio um electrão, ora se tinha
teoricamente ganho dois electrões e teoricamente perdeu um electrão significa
que o segundo átomo de Carbono tem na realidade nox igual a -1. Por fim, o
átomo Oxigénio ligado ao Carbono e ao Hidrogénio simultaneamente tem nox igual
a -2 pois aparentemente recebe um electrão do Carbono e outro electrão do
Hidrogénio e o Hidrogénio tem nox igual a +1 visto que aparentemente cede o seu
electrão ao Oxigénio.
Geralmente, o Carbono
nos compostos orgânicos apresenta distintos números de oxidação por isso
normalmente calcula-se o nox médio do Carbono, que corresponde à soma dos nox
de cada átomo de C dividido pelo número de átomos de C presentes na molécula.
Por: Miguel
Pascoal
full-width










0 Comentários