PRÉ-QUÍMICO
________________________________________________________________________________
Concentração em mol/l
__________________________________________________________________________________
Introdução
A concentração em mol por litro é também chamada de concentração molar ou simplesmente molaridade. Representa-se geralmente pela letra “ M ”, contudo há quem usa “ CM ” que significa concentração molar.
Definição
Concentração em mol por litro é a quantidade de matéria (no de mols) do soluto existente em um litro (1L) de solução.
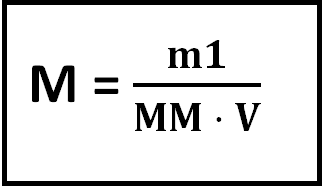
A expressão para o cálculo da concentração em mol/l é:

A unidade da concentração molar ou molaridade é mol/l . Mas também escreve-se (usa-se) simplesmente a palavra “molar” ou a letra “M” , que é a mesma coisa que mol/l.
Por exemplo, 2 mol/l, pode escrever-se 2M (2 molar).
Se analisarmos muito bem, podemos observar que para o cálculo do número de mols (quantidade de matéria) usamos a expressão:

Onde:
- n – número de mols
- m – massa
- M M – massa molar
Então assim sendo podemos escrever a expressão para o cálculo da molaridade assim:

Obs: MM é a massa molar do soluto!
Relação entre concentração comum (C) e molaridade (M)
Existe um a relação entre destas duas formas de expressão da concentração que resultará numa outra expressão:
Relembrando que a concentração comum (C) é dada pela expressão:

E a molaridade é dada por:
Então dividindo “C” por “M” teremos:

Exemplo:
Calcule a molaridade de uma solução obtida pela dissolução de 1,25 gramas de Hidróxido de sódio (NaOH) em 100mL de água destilada.
Resolução
O primeiro passo para a resolução deste exercício é reunirmos os dados fornecidos pelo exercício:
Dados
Massa do soluto (m1 ) = 1,25g
Volume da solução (V) = 100mL
M = ?
A seguir vamos calcular o número de mols do soluto que corresponde a 1,25g de Hidróxido de sódio. Entretanto para o cálculo do número de mols temos que calcular a massa molar do hidróxido de sódio:
M M (NaOH) = 23 + 16 + 1 = 40g/mol
A massa molar do NaOH é de 40g/mol, o que significa que 1 mol de hidróxido de sódio corresponde a 40g:
1 mol de NaOH --------- 40 gramas
Se 1 mol de NaOH corresponde a 40 gramas, então 1,25 gramas correspondem a quantos mols? Então temos:
1 mol de NaOH --------- 40 gramas
n mol de NaOH ---------- 1,25g

E agora temos que converter o volume para litros pois aqui é dado em mL :
1 Litro ------- 1000mL
V Litros ------ 100mL

Aplicar a fórmula usada para o cálculo da concentração em mol/l:

Isto significa que em 1 litro desta solução temos 0,3125 mols.
___________________________________________________________________________
EXERCÍCIOS RESOLVIDOS
1 . Calcule a massa de hidróxido de sódio necessária para preparar meio litro de solução a 0,2 molar.
Resolução
Primeiro reunir os dados, pois isso facilita na resolução:
Dados
Composto: Hidróxido de sódio (NaOH)
Volume da solução: meio litro, ou seja, 0,5L
Concentração molar: 0,2M ou 0,2 mol/l
Agora temos que calcular a massa molar do hidróxido de sódio:
M M1(NaOH) = 23 + 16 + 1 = 40g/mol
Aplicar a fórmula usada para o cálculo da molaridade: Porém este exercício pode ser resolvido usando a fórmula:

assim como usando a fórmula:

Resolução 1:
Aqui aplicaremos a fórmula:

Usando esta fórmula para o presente exercício é mais fácil porque é só substituirmos os dados na fórmula e isolarmos a massa “m1 ”:

Resposta : São necessários 4 gramas de hidróxido de sódio para preparar a solução.
Resolução 2
Aqui aplicaremos a fórmula:

Usando esta fórmula, temos que isolar o “n1”:
n1 = M · V
n1 = 0,2 mol/l · 0,5L
n1 = 0,1 mol
Pela massa molar do hidróxido de sódio temos: MM (NaOH) = 23 + 16 + 1 = 40g/mol
1 mol de NaOH --------- 40 gramas
0,1 mol de NaOH ---------- X

Como podemos ver usando as duas fórmulas obtemos o mesmo resultado.
2 . Qual é a molaridade de uma solução de ácido clorídrico que apresenta concentração igual a 146 g/L? (Massas atómicas: H = 1; Cl = 35,5)
Resolução
Primeiro calcular a massa molar do ácido clorídrico:
MM (HCl) = 1 + 35,5 = 36,5g/mol
Agora é só aplicarmos a relação entre a concentração comum (C) e a molaridade (M): C = M · MM

_____________________________________________________
EXERCÍCIOS PARA RESOLVER
1 . Calcule a concentração em mol/l de uma solução de ácido sulfúrico preparada pela dissolução de 4g deste ácido em 1500mL de água.
2 . ( UCS-RS) Uma pessoa usou 34,2 g de sacarose (C12H22O11) para adoçar seu cafezinho. O volume de cafezinho adoçado na xícara foi de 50 mL. Qual foi a concentração da sacarose nesse cafezinho?
a) 0,5 mol/L
b) 1,0 mol/L
c) 1,5mol/L
d) 2,0 mol/L
e) 2,5 mol/L
3 . Qual é o volume necessário para preparar uma solução de NaOH a 2M obtida pela dissolução de 1,6g dessa base (hidróxido)?
a ) 20mL
b ) 1000mL
c ) 0,8mL
d ) 0,002mL
_______________________________________
Respostas
1. R: 0,027 mol/L
2. R: 2 mol/L
3. R: 0,02L = 20mL
Nota: 1L = 1000mL
BONS ESTUDOS!!!
OBRIGADO POR TERES LIDO.
______________________________________________________________________________
AUTORIA: O PRÉ-QUÍMICO
Maputo – Moçambique







0 تعليقات