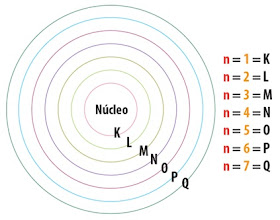
Níveis de energia
De acordo com Bohr, as órbitas circulares do electrão correspondem a níveis de energia bem definidos sendo caracterizados por números inteiros, 1, 2, 3, 4, 5, 6 e 7 para todos os átomos actualmente conhecidos. Os níveis de energia também podem ser designados de camadas electrónicas sendo representadas pelas letras K, L, M, N, O, P e Q, assim, as camadas K, L, M, N, O, P e Q, correspondem aos 1o, 2o, 3o, 4o, 5o, 6o e 7o níveis de energia.
Cada uma das
camadas electrónicas comporta um número máximo de electrões que pode ser determinado
teoricamente por 2n2,
sendo n o nível de energia. Assim:
|
Nível de energia (n) |
Camadas |
Número máximo de e- |
|
1 |
K |
2 |
|
2 |
L |
8 |
|
3 |
M |
18 |
|
4 |
N |
32 |
|
5 |
O |
50 |
|
6 |
P |
72 |
|
7 |
Q |
98 |
Entretanto, na
prática verifica-se o número máximo de electrões em cada nível é:
|
Camada |
K |
L |
M |
N |
O |
P |
Q |
|
No máximo de e- |
2 |
8 |
18 |
32 |
32 |
18 |
8 |
Subníveis de energia
A construção de aparelhos mais avançados permitiu aos cientistas observarem que os espectros descontínuos eram na verdade constituídos por duas ou mais linhas muito finas muito próximas umas das outras, assim, os cientistas concluíram que os níveis de energia eram constituídos por subdivisões que chamaram de subníveis de energia ou subcamadas.
Normalmente os subníveis de energia são designados pelas letras s, p, d, f, g, h, etc. Os subníveis g, h… etc são teóricos já que não se conhece nenhum átomo com o número de electrões suficiente para preencher estes subníveis.
Por: Miguel
Pascoal
full-width








0 تعليقات