No texto, Hidrólise Salina vimos que certos iões (catiões e aniões)
provenientes da dissociação de um sal reagem com a água num processo designado
de hidrólise.
Na hidrólise de um ião proveniente de um sal estabelece-se sempre um equilíbrio
dinâmico. Por exemplo, a hidrólise de um ião qualquer, A-, envolve o
seguinte equilíbrio:
A- + H2O ⇌ HA + OH-
Por se tratar de um sistema em equilíbrio podemos expressar a sua constante de equilíbrio como:
A concentração da água é constante por isso pode ser incluída na constante de equilíbrio, Kc:
O
produto Kc · [H2O] é uma constante, ou seja, define uma
nova constante que é designada de constante
de hidrólise, Kh:
Kc
· [H2O] = Kh
Portanto,
Assim,
o valor de Kh nos permite avaliar a capacidade que um determinado
sal tem de sofrer hidrólise. Quanto maior for Kh , maior será o grau
em que a hidrólise desse sal ocorrerá.
Exemplos
a) NH4Cl
Este sal em solução aquosa dissocia-se completamente de acordo com a
equação:
NH4Cl(s) + H2O(l) → NH4+(aq)
+ Cl-(aq)
O ião Cl- não sofre hidrólise pois provém de um ácido forte
(HCl). Por conseguinte, o ião amónio, NH4+ se hidrolisa
de acordo com o seguinte equilíbrio:
NH4+ + H2O ⇌ NH3 + H3O+
A constante de hidrólise é:
Visto que a hidrólise deste catião conduz a um aumento significativo da concentração de iões H3O+, então essa constante de hidrólise é na realidade uma constante de acidez do ião amónio. (NH4+).
b) KCN
Este sal em solução aquosa dissocia-se completamente de acordo com a
equação:
KCN(s) + H2O(l) → K+(aq)
+ CN-(aq)
O ião K+ não sofre hidrólise pois provém de uma base forte
(KOH). Por conseguinte, o ião cianeto, CN-, se hidrolisa de acordo
com o seguinte equilíbrio:
CN- + H2O ⇌ HCN + OH-
A constante de hidrólise é:
Visto que a hidrólise do anião CN- conduz a um aumento
significativo da concentração de iões OH-, então essa constante de
hidrólise é na realidade uma constante de basicidade do ião cianeto (CN-).
RELAÇÃO ENTRE
A CONSTANTE DE HIDRÓLISE E CONSTANTE DE ACIDEZ OU DE BASICIDADE
Consideremos a hidrólise de um ião qualquer A-
A- + H2O ⇌ HA + OH-
Este ião está actuando como uma base já que se hidrolisa provocando um
aumento na concentração de iões hidroxilo (OH-). A substância HA
formada é o ácido conjugado da base A-, se este ácido reagir com a
água dará origem ao ião A-:
HA + H2O ⇌ H3O+ + A-
Para o primeiro equilíbrio podemos definir a constante de hidrólise e para o segundo a constante de
acidez:
Com base nestes dois equilíbrios podemos
estabelecer uma relação quantitativa entre a constante de hidrólise (do
primeiro equilíbrio) e a constante de acidez (do segundo equilíbrio):
Para já somemos as duas equações:
Veja que o somatório das duas equações resulta no produto iónico da água, Kw, assim, a constante de
hidrólise e constante de
acidez estão de alguma forma
relacionadas ao produto iónico da água, Kw.
Considerando que ao
somarmos duas equações para obtermos uma terceira equação, a constante de equilíbrio da terceira equação é igual ao produto das constantes das duas equações somadas. Portanto, podemos deduzir que
Kh e Ka relacionam-se com o produto iónico da água através da seguinte expressão:
Kh · Ka = Kw
A seguir vamos demonstrar que isso é verdade, observe:
Kh · Ka = [H3O+] · [OH-]
Sendo, Kw
= [H3O+] · [OH-], ficamos com:
Kh · Ka = Kw
Assim, podemos escrever:
Esta expressão mostra-nos que quanto mais fraco for o
ácido maior será o grau em ocorrerá a hidrólise do sal.
No caso da hidrólise de um catião, o raciocínio é basicamente o mesmo que foi anteriormente explicado:
BH+ + H2O
⇌ B + H3O+
A constante de hidrólise é:
B + H2O ⇌ BH+ + OH-
A constante de basicidade é:
Portanto,
Kh · Kb = [H3O+]
· [OH-]
Kh · Kb = Kw
Assim, podemos escrever:
Esta expressão mostra-nos que quanto mais fraca for a
base maior será o grau em ocorrerá a hidrólise do sal.
Por: Miguel Pascoal
full-width






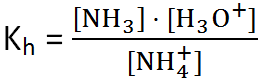








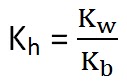





0 Comentários