FÓRMULA
MOLECULAR
É aquela que indica a quantidade e o tipo de
átomos que constituem a substância.
A
fórmula molecular indica o número exacto (real) de átomos de cada elemento numa
substância.
Há casos em que a fórmula mínima é igual a fórmula
molecular e noutros casos verifica-se que a fórmula molecular é um múltiplo
inteiro da fórmula mínima, assim temos:
Fórmula
molecular = n · (Fórmula mínima)
O n é sempre um número inteiro que pode ser determinado pela seguinte expressão:
Portanto:
Assim, para a determinação da
fórmula molecular pode-se usar dois caminhos. O primeiro deles é partir da
fórmula mínima para chegar a fórmula molecular e o segundo consiste em fazer um
cálculo directo sem ter que obter a fórmula mínima primeiro.
a)
Determinação da fórmula molecular a partir da fórmula mínima
Exemplo: A cafeína contém 49,48% de carbono, 5,15% de
hidrogénio, 28,86% de nitrogénio e 16,49% de oxigénio. A massa molar é 194
g/mol. Determine a fórmula molecular da cafeína.
1o
Passo: Passar as percentagens de cada
elemento para massa em gramas considerando 100 g de substância:
2o Passo: Determinar o número de moles de cada elemento, ou seja, dividir a
massa de cada elemento pela respectiva massa molar:
3o Passo: Escolher o menor número obtido e dividir todos os outros por ele,
neste caso é o 1,03:
Assim a fórmula mínima é: C4H5N2O
4o
Passo: Determinar a massa molar da
fórmula mínima
M(C4H5N2O) = 4 x 12 + 5 x 1 + 2 x 14
+ 16 = 97
5o
Passo: Determinar o valor de “n”:
6o
Passo: Determinar a fórmula molecular:
Fórmula
molecular = n · (Fórmula mínima)
Fórmula molecular= 2 · (C4H5N2O)
Fórmula molecular = C8H10N4O2
b) Determinação da fórmula molecular sem obter a
fórmula mínima
Exemplo: Um composto orgânico apresenta a seguinte
composição centesimal: C – 65,30%; H – 3,40%; N – 9,52% e C – 21,78%. Calcular
a sua fórmula molecular sabendo que a massa molecular é 147.
1o
Passo: Neste caso nos é dada a massa
molecular da substância e as percentagens de cada elemento na substância, assim
temos que determinar a massa de cada elemento presente no composto com base nas
percentagens de cada elemento:
2o Passo: Dividir as massas obtidas pelas respectivas massas molares de cada
elemento químico:
3o Passo: Escrever a fórmula molecular da substância
A fórmula molecular é: C8H5NO2
EXERCÍCIO RESOLVIDO
Uma amostra de 4,5 g de um composto orgânico que
contém apenas C, H e O como constituintes foi queimada completamente com gás
oxigénio em excesso e, como resultado, foram obtidos 6,6 g de CO2 e
2,7 g de H2O. Com esses dados, pode-se concluir que a fórmula
empírica desse composto é
Dados: massas molares (g/mol): H = 1,0, C = 12,0 e
O = 16,0
a) C2H4O
b) CH2O
c) C2H6O
d) C4H2O5
e) C6H3O8
RESOLUÇÃO
Na queima completa de um composto orgânico o
carbono é transformado em dióxido de carbono e o hidrogénio em água. Então o
primeiro passo é determinar a massa de carbono existente em 6,6 g de CO2
e a massa de hidrogénio existente em 2,7 g de H2O.
O
somatório das massas de C, H e O deve ser igual a massa do composto queimado
(4,5 g):
mC + mH + mO = 4,5 g
1,8 g + 0,3 g + mO = 4,5 g
2,1 + mO = 4,5 g ⇔
mO = 4,5 – 2,1 = 2,4 g O
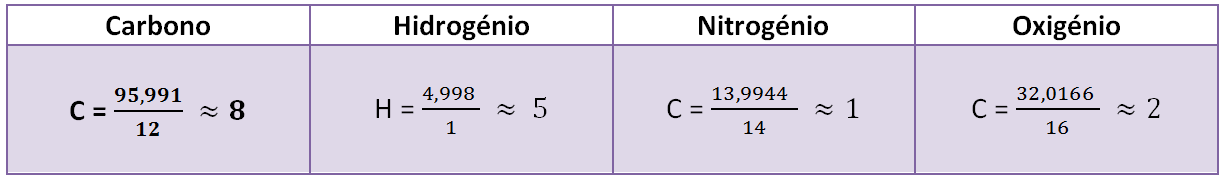
Determinar o número de moles de cada elemento
Escolher o menor número e dividir todos os outros
A
fórmula empírica é: CH2O
Alternativa: B
Por: Miguel Pascoal


















0 Comentários